惊现57%完全缓解率!2025世界癌症日高光时刻:四大突破疗法拯救胰腺癌、结直肠癌、血癌等
小编 2025-02-12
2025年世界癌症日高光时刻:细胞免疫治疗法和癌症疫苗四大突破性疗法拯救胰腺癌、结直肠癌、血癌等
为了在全球范围内推进癌症防治行动,遏制全球癌症发病率和死亡率的上升趋势,国际抗癌联盟(UICC)与世界卫生组织(WHO)于2000年在巴黎召开了世界肿瘤高峰会议,并签署了《巴黎抗癌宪章》。宪章规定,每年2月4日为“世界癌症日”,号召在这一天,全球同步开展肿瘤防治宣传工作,内容涵盖科普宣传、康复宣传等。
2025年2月4日,第二十六个“世界癌症日”刚刚过去,今年的主题是“UnitedbyUnique(因独特而团结)”。这一主题秉持以人为本、携手抗癌的治疗理念,将个体需求置于医疗保健决策的核心位置,旨在提高人们对癌症患者独特需求的认知,呼吁在肿瘤防治工作中,更加关注患者的特殊情况,进而推动制定更具针对性的预防和治疗方案。我们也很惊喜的看到最近一年全球在抗癌领域取得的重大进展,比如全球首款TIL细胞疗法(Lifileucel)、TCR-T细胞疗法(Afami-cel)等相继获批上市……
小编依据2025世界癌症日的最新理念,梳理了肿瘤细胞及癌症疫苗治疗领域当下的一些热点与进展,以供癌友们参考,帮助大家坚定抗癌决心。这些热点和进展展现出肿瘤细胞治疗领域的迅猛发展态势,也为癌症患者带来了更多的希望与选择!

▲截图源自“CGTlive”
免疫细胞疗法及癌症疫苗的四大突破性进展
全球首款无需REMS的CAR-T疗法——Aucatzyl获批上市,B细胞前体急性淋巴细胞白血病完全缓解率高达57%
2024年11月8日,美国食品药品监督管理局(FDA)批准了一款新型CAR-T细胞疗法——Aucatzyl(obe-cel,obecabtagene autoleucel)的上市申请,用于成人复发或难治性B细胞前体急性淋巴细胞白血病(r/r B-ALL)的治疗。这是一款靶向CD19的转基因自体CAR-T细胞免疫疗法,同时也是首个无需风险评估缓解策略(REMS)计划的CAR-T疗法!该药的出现将大大简化使用和监管流程,有助于加快CAR-T细胞疗法的临床应用!
“成人急性淋巴细胞白血病(ALL)是一种极具侵袭性的癌症,一旦患者复发,过往的治疗手段往往效果欠佳,难以有效控制病情。如今,Aucatzyl的获批上市,无疑为复发或难治性 B 细胞前体急性淋巴细胞白血病(r/r B - ALL)的成人患者带来新的曙光,并已表现出较好的临床疗效”。
——德克萨斯大学MD安德森癌症中心白血病和ALL科室主任:Elias Jabbour博士
Aucatzyl本次获批,主要是基于一项Ib/II期FELIX临床研究的惊艳数据(NCT04404660)。本次共纳入126例复发/难治性急性淋巴细胞白血病患者,入组接受Aucatzyl治疗,中位随访时间为11.0个月。
结果显示:在124名可评估疗效反应的患者中,有95名患者符合相关评估标准。这些患者的治疗效果显著,完全缓解(CR)率高达57%(即124名患者中有71名达到完全缓解),CR/CRi(“完全缓解”或“完全缓解但计数不完全恢复”)率更是高达77%。此外,高达96%的患者达到了微小残留病灶(MRD)阴性状态,12个月的无事件生存率(EFS)约为50%(详见下图)。
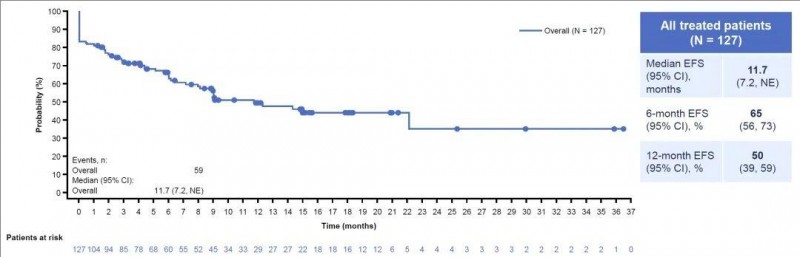
▲图源“ASH”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
新型CAR-T细胞疗法——Arlo-Cel携多发性骨髓瘤长期随访数据亮相2024 ASH大会,87%的总缓解率轰动全场
在2024年12月7~10日举办的第66届美国血液学会(ASH)年会上,一项新型CAR-T细胞疗法——Arlo-Cel(Arlocabtagene autoleucel,BMS-986393)凭借1期CC-95266-MM-001临床试验87%的总缓解率惊艳全场。
▲截图源自“OneLive”
Arlo-Cel是一款靶向GPRC5D(新型MM疗法的一个有希望的靶点),已获得FDA再生医学先进疗法认证,用于既往接受过大量治疗的多发性骨髓瘤(MM)的治疗。
根据2024年ASH年会上公布的1期试验(CC-95266-MM-001;NCT04674813)的最新结果,Arlo-Cel(BMS-986393)在接受过大量治疗的复发/难治性多发性骨髓瘤患者中表现出令人鼓舞的抗肿瘤活性和可接受的安全性(数据同步发表在《血液学》杂志中)。
本次纳入中位年龄为63岁(范围39-80)的多发性骨髓瘤(MM)患者,先前接受治疗方案的中位数为5种(范围3-15)。其中,76%的患者患有三重难治性疾病,35%的患者患有五重难治性MM。截至2024年5月20日,共有84例患者接受了BMS-986393治疗,26名患者接受推荐2期剂量(RP2D)治疗。
结果显示:在总体疗效可评估人群(n=79)中,总缓解率(ORR)为87%,其中完全缓解(CR)率为53%,42%的患者达到严格CR(sCR),部分缓解(PR)率为11%,非常好的部分缓解(VGPR)率为23%。
而在接受推荐2期剂量(RP2D)CART细胞治疗的患者(n=23)中,总缓解率(ORR)更是高达91%,完全缓解(CR)率为48%,35%的患者达到严格CR(sCR),PR率和VGPR率均为22%。
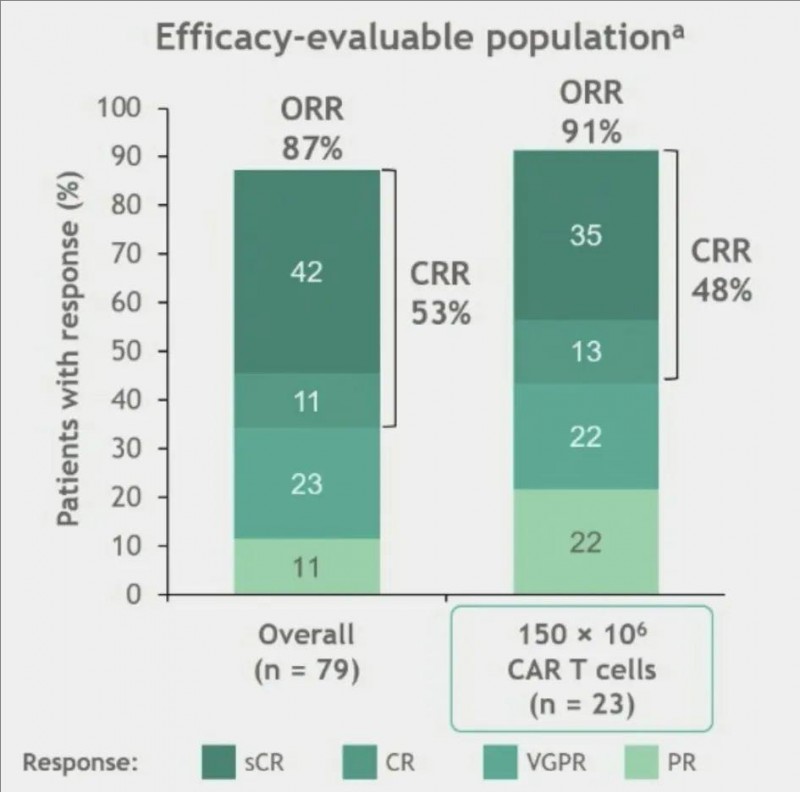
▲图源“Blood”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
总之,在对GPRC5D靶向CART疗法进行最长的随访后,Arlo-Cel(BMS-986393)显示出较高的持久反应率,并且随着时间的推移而加深。无论疾病特征如何,反应率都很高,包括初治患者和接受过BCMA靶向疗法的患者,以及高风险细胞遗传学、三级难治性和髓外疾病患者。这也意味着,Arlo-Cel的治疗反应和最终疗效不受患者既往接受治疗情况的制约。基于此,Arlo-Cel有望成为经过大量预处理的复发或难治性多发性骨髓瘤的潜在治疗方案,为这类患者带来新的希望与选择!
个性化新抗原疫苗BNT122三年随访数据公开,胰腺导管腺癌中位无复发生存超13个月
2024年4月7日,在2024年美国癌症研究协会(AACR)年会上,BioNTech以口头报告的形式,公布了个性化mRNA新抗原疫苗BNT122(自体cevumeran,RO7198457)针对胰腺导管腺癌(PDAC)的1期临床试验长达3年的随访数据。
数据显示,在参与试验的16例患者中,有8例在接受BNT122给药后,长达3年的时间里引发了免疫反应。更令人惊喜的是,其中6例患者在3年的随访期内一直保持无病状态。
▲截图源自“BioNTech”
BNT122(RO7198457,自体cevumeran)是一款可编码20余种特异性新抗原的个体化新抗原mRNA疫苗,可用于治疗胰腺导管腺癌(PDAC),以降低复发率,延长生存时间。
2024 AACR年会上公布的“BNT122治疗胰腺导管腺癌的Ⅰ期临床研究(NCT04161755)”数据,也同步发表在了世界权威期刊《Nature》上。本次共纳入34例胰腺导管腺癌(PDAC)患者(其中28例接受过手术治疗)。19例患者在术后接受Atezolizumab(阿替利珠单抗)治疗,其中部分患者随后接受了BNT122疫苗接种(16例)、改良版四药化疗方案(mFOLFIRINOX,包括亚叶酸、氟尿嘧啶、奥沙利铂、伊立替康)(15例)治疗。
结果显示,8例无应答患者的中位无复发生存时间(RFS)达13.4个月之久(P=0.003,95% CI:0.01–0.4)(详见下图)。
▼安全性可评估队列中(n=19)患者的中位无复发生存时间(RFS)
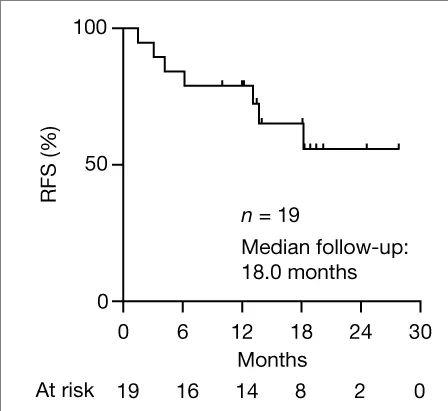
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,其中29号患者治疗后短暂出现血清CA19-9水平升高、新的肝脏病变(7mm),但该病变在随后的影像学检查中消失了,这表明该疫苗可能具有根除微转移病灶的能力(详见图2)。
▼接种BNT122疫苗前后,29号患者的腹部MRI对比
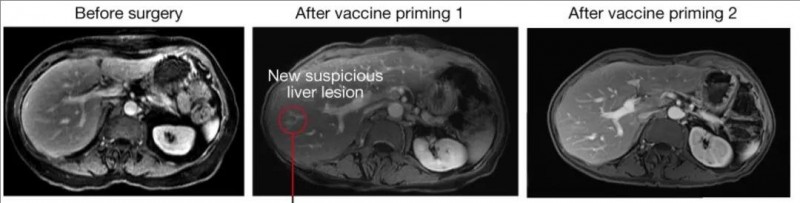
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,Ⅰ期临床数据表明,BNT122与mFOLFIRINOX+Atezolizumab联用是安全可行的,且疫苗扩增的T细胞,有助于预防肿瘤复发。
好消息是,目前我国有多款CAR-T细胞疗法及一款mRNA癌症疫苗已启动临床,这也意味着中国患者也有免费申请CAR-T及癌症疫苗治疗的机会了!想了解更多讯息的患者,可将治疗经历、近期病理及影像学检查报告等,提交至医学部,进行初步评估!
ELI-002疫苗打破"KRAS难成药魔咒",6例胰腺癌/结直肠癌患者奇迹般达到完全缓解
2025年1月23日,美国食品药品监督管理局(FDA)针对一款治疗性癌症疫苗——ELI-002的潜在3期试验关键要素,给出了支持性反馈,内容涵盖研究设计、剂量设定、时间表安排、患者人群选择以及主要终点分析等。依据FDA的反馈,预计将根据计划中的3期试验结果,提交这款治疗性癌症疫苗的生物制品许可申请(BLA)。这也意味着,这种新型癌症治疗性疫苗离患者又近了一步!

▲截图源自“Targeted”
KRAS突变是一种常见的基因突变类型,在胰腺癌、肺癌、结直肠癌、肝癌、甲状腺癌、膀胱癌、卵巢癌、乳腺癌等多种癌症中均有发现。遗憾的是,长期以来,KRAS突变靶点一直被认为“无法成药”。
而ELI-002是一款针对KRAS突变的治疗型癌症疫苗,主要针对KRAS突变阳性实体瘤,尤其是胰腺导管腺癌(93%)、结直肠癌(52%)。这款疫苗的优势十分突出,它无需进行单独设计,就能刺激机体免疫系统识别和攻击癌细胞,从而免去了复杂的流程,大大缩短了疫苗制作时间,具有广阔的应用前景!ELI-002的成功研发,为攻克“KRAS无法成药”的难题提供了新的解决方案,同时也为那些病情急迫的癌症患者带来了新的希望!
2024年1月,世界权威期刊《Nature》公布了“ELI-002疫苗1期AMPLIFY-201临床试验(NCT05726864)”的振奋数据!
截至2023年4月25日,共有25例mKRAS驱动的高复发风险的癌症患者入组(包括胰腺癌20例、结直肠癌5例),中位年龄61.0岁(范围37-77岁),这些患者既往均接受过手术和化疗,28%的患者接受过放疗,肿瘤标志物CA19-9及ctDNA检测仍提示有残留癌症(阳性)。入组后,接受为期6个月的ELI-002单一辅助治疗。经过为期2年的随访,结果显示:
在23例可评估的患者中,治疗6个月时,77%患者出现肿瘤标志物减少,其中6例患者更是达到了完全缓解(CR),这意味着这6例患者的癌症被清除了!此外,入组的25例患者,从第一剂疫苗接种日期起,中位总生存期(OS)达16.33个月(详见下图)。
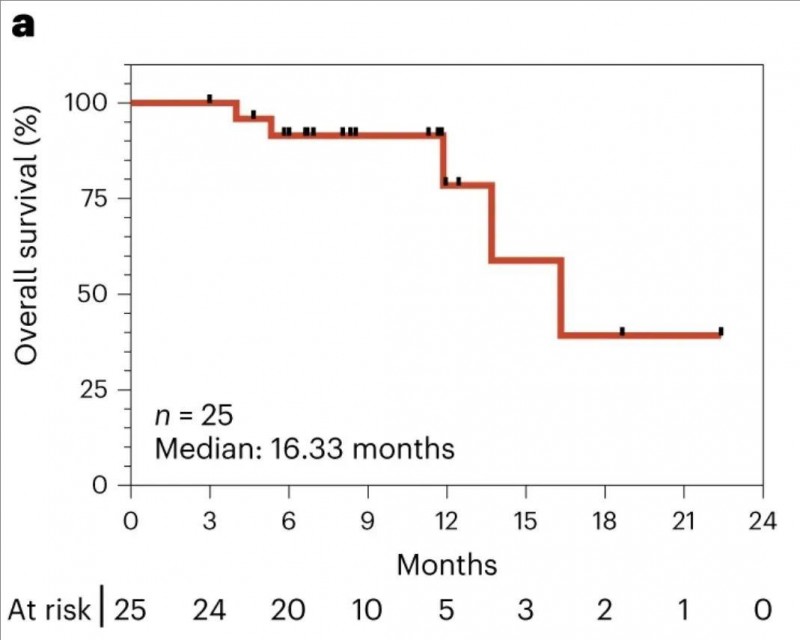
▲图源“nature medicine”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
更为惊喜的是,入组患者均未见严重不良反应(≥3级)。仅48%的患者在治疗后,出现了1或2极相关不良反应,包括疲劳、肌痛、注射部位反应等。
综上,ELI-002疫苗显著降低了患者肿瘤标志物水平,并产生了强烈的T细胞应答,从而降低了患者复发及死亡的风险,且总体上被认为是安全可控的。
小编寄语
癌症作为一种高度突变且极度狡猾的疾病,目前很难仅依靠单一疗法,达到预期治疗效果。现阶段理想的抗癌治疗,是依托于权威医院和权威专家的早期规范诊断,并在传统治疗(入手术、放化疗)的基础上,根据患者自身情况、疾病特点、经济状况等,辅以免疫细胞疗法(如CAR-T、TCR-T、TIL、NK、CAR-NK细胞疗法)、癌症疫苗、靶向药物、硼中子俘获疗法、质子治疗等抗癌新药/新技术,以预防癌症复发或转移、尽可能延长生存期、提高患者的生存质量。
对现阶段治疗方案不满意的患者,可将近期影像及病理检查报告、治疗经历等,提交至全球肿瘤医生网医学部,详细评估病情,或申请国内外抗癌专家会诊,寻求抗癌新药/新技术的帮助。
参考资料
[1]Roddie C,et al.Obecabtagene autoleucel (obe-cel, AUTO1) for relapsed/refractory adult B-cell acute lymphoblastic leukemia (R/R B-ALL): pooled analysis of the ongoing FELIX phase Ib/II study[J]. Blood, 2023, 142: 222.
https://ash.confex.com/ash/2023/webprogram/Paper179454.html
[2]Bal S,,et al.Efficacy and Safety with Extended Follow-up in a Phase 1 Study of BMS-986393, a G Protein-Coupled Receptor Class C Group 5 Member D (GPRC5D)-Targeted CAR T Cell Therapy, in Patients (pts) with Heavily Pretreated Relapsed/Refractory (RR) Multiple Myeloma (MM)[J]. Blood, 2024, 144: 922.
https://www.sciencedirect.com/science/article/pii/S0006497124036693
[3]Yarchoan M,et al.Personalized neoantigen vaccine and pembrolizumab in advanced hepatocellular carcinoma: a phase 1/2 trial[J]. Nature medicine, 2024: 1-10.
https://www.nature.com/articles/s41591-024-02894-y
[3]Pant S,et al.Lymph-node-targeted, mKRAS-specific amphiphile vaccine in pancreatic and colorectal cancer: the phase 1 AMPLIFY-201 trial[J].Nature medicine,2024:1-12.
https://www.nature.com/articles/s41591-023-02760-3
[4]https://investors.biontech.de/news-releases/news-release-details/three-year-phase-1-follow-data-mrna-based-individualized
[5]https://www.onclive.com/view/arlo-cel-elicits-87-orr-in-heavily-pretreated-relapsed-refractory-multiple-myeloma
[6]https://www.targetedonc.com/view/fda-supports-registrational-strategy-for-eli-002-in-kras-driven-cancers












