肠道菌群联合抗PD-1+抗VEGF,助晚期转移性结直肠癌患者缔造完全缓解奇迹!
小编 2024-12-17
肠道菌群抗癌,肠道菌群联合抗PD-1+抗VEGF,助晚期转移性结直肠癌患者缔造完全缓解奇迹!
全球知名医学期刊《Cureus》报道了我国近期进行的全球首例“应用粪便菌群移植(FMT)胶囊联合替雷利珠单抗+贝伐单抗,治疗IV期错配修复充分(pMMR)和微卫星稳定(MSS)的晚期或转移性结直肠癌(mCRC)”的案例。
既往,pMMR MSS CRC(错配修复充分和微卫星稳定的晚期或转移性结直肠癌)对免疫疗法几乎没有反应,而该例患者通过粪便菌群移植(FMT),将肿瘤大小缩小至可进行根治性手术的范围,并最终破天荒地实现了病理完全缓解(pCR)!
结直肠癌遇新克星?粪便微生物移植为结直肠癌患者开辟新的治疗路径
结直肠癌 (CRC) 是全球第三大常见恶性肿瘤,仅次于乳腺癌和肺癌。近年来,由于生活方式和饮食习惯的改变,中国 CRC 发病率和死亡率呈上升趋势。雪上加霜的是,由于筛查方案和方法不完善,约25% 的患者确诊为晚期或转移性 CRC (mCRC),即便接受抗表皮生长因子受体 (anti-EGFR) 、抗血管内皮生长因子 (anti-VEGF)等一线治疗后,预后仍不理想。因此,对于那些在接受一线治疗后病情进展的患者,迫切需要寻求新的替代疗法。
肠道是人体最大的消化器官,同时也是机体与外界接触最大的器官之一,人体约70%左右的免疫细胞都聚集于此,肠道内蕴含着百万亿的微生物群(包括真菌、病毒、细菌等),它们共同守护着宿主的健康。肠道菌群通过调节肠道致癌微环境、激活模式识别受体、调节微生物代谢物、短分子模拟等方式,实现抗肿瘤作用。
而近年,随着人们对紊乱的肠道菌群与多种疾病之间关系的认识不断加深,粪便菌群移植(FMT)已成为一种新兴的生物治疗手段,可通过 FMT 控制肠道微生物,从而影响免疫系统,并激活 T 细胞、树突状细胞和巨噬细胞等,最终达到抗癌目的。
免疫检查点抑制剂 (ICI) 在治疗晚期或转移性结直肠癌 (mCRC) 方面显示出巨大潜力,尤其是对于错配修复缺陷 (dMMR) 和微卫星不稳定性高 (MSI-H) 的结直肠癌患者。但对于错配修复充分 (pMMR) 和微卫星稳定 (MSS) 或低微卫星不稳定性 (MSI-L) 的 CRC 患者,则治疗效果不佳,而粪便微生物移植 (FMT)的应用,则为这类患者带来了新的希望与选择!
粪便菌群移植联合替雷利珠单抗+贝伐单抗,助晚期转移性结直肠癌患者实现病理完全缓解
全球知名医学期刊《Cureus》报道了我国近期进行的全球首例“应用粪便菌群移植(FMT)胶囊联合替雷利珠单抗+贝伐单抗,治疗IV 期错配修复充分(pMMR)和微卫星稳定(MSS)的晚期或转移性结直肠癌(mCRC)”的案例。
既往,pMMR MSS CRC(错配修复充分和微卫星稳定的晚期或转移性结直肠癌)对免疫疗法几乎没有反应,而该例患者通过粪便菌群移植(FMT),将肿瘤大小缩小到可进行根治性手术的范围,并最终破天荒地实现了病理完全缓解(pCR)!
该患者为一位57岁中国男性,确诊为升结肠错配修复充分(pMMR) cT4bN2M1b IVb晚期或转移性结直肠癌(mCRC),并伴有继发性肝脏恶性肿瘤,患者半个月来出现反复腹痛、大便形状异常等表现。KRAS/NRAS/BRAF基因突变检测,提示患者为KRAS/NRAS/BRAF野生型。
该患者入组后共接受了三次治疗,首先入组II期临床试验,第一次接受了CPGJ602+mFOLFOX6[奥沙利铂+氟尿嘧啶(5-FU),顺铂和氟尿嘧啶(CF)]治疗,但治疗效果不理想。遂接受第二次治疗,方案为贝伐单抗联合FOLFOXIRI[L-OHP+伊立替康(CPT)+亚叶酸钙(LV)],在完成三个周期治疗后,CT结果显示治疗后患者获得部分缓解(PR)。但由于高强度化疗引起的消化道反应、骨髓抑制等副作用,使患者不愿继续治疗,加之该患者病情不允许进行根治性手术切除,故接受第三次新的治疗方案,即口服肠菌群胶囊,同时联合替雷利珠单抗(Tislelizumab)+贝伐单抗(Bevacizumab)治疗。结果显示如下:
1、病灶显著缩小,最终达部分缓解:CT结果显示,该患者治疗后达到部分缓解(PR),结肠肿瘤由3.7cm×3.1cm缩小至2.1cm×1.7cm,腹膜后淋巴结转移由5.2cm×4.3cm缩小至2.3cm×1.4cm,肝脏肿瘤由3.9cm×3.2cm缩小至2.9cm×2.3cm。
▼第二次治疗及第三次治疗后,患者腹部轴向CT图像显示病变大小对比图

▲图源“Cureus”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:
①第二次治疗后,结肠肿瘤和淋巴结转移灶缩小,而肝脏转移灶大小基本保持不变。
②第三次治疗后,结肠肿瘤、淋巴结转移灶、肝脏转移灶均缩小,达到PR(部分缓解)。
▼不同阶段治疗后结肠肿瘤大小、腹膜后淋巴结转移灶及肝转移灶情况
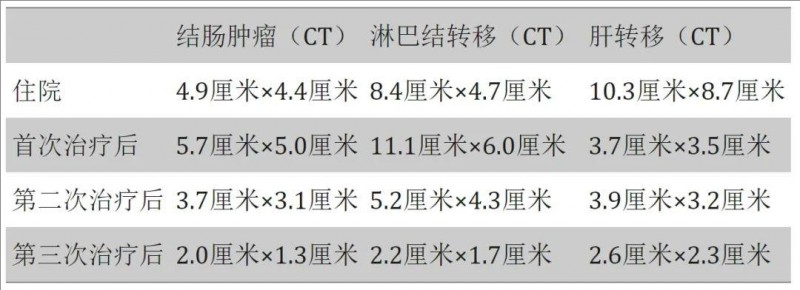
▲数据源自“Cureus”
2、肿瘤标志物显著下降:第三次治疗结束后,癌胚抗原 (CEA)从住院时的30.1μg/L(微克/),骤降至4.3μg/L;CA19-9从住院时的62.64kU/L(千单位/升),骤降至23.97kU/L(详见下表)。
▼不同阶段治疗后的肿瘤标志物水平
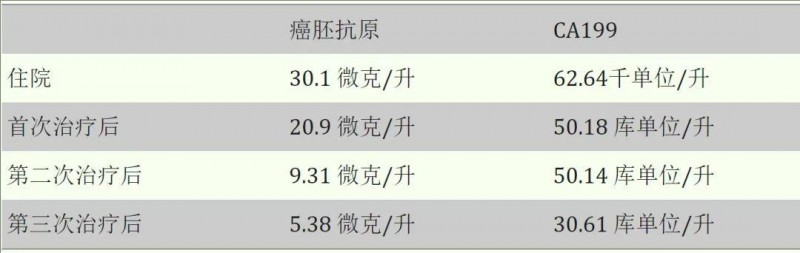
▲数据源自“Cureus”
小编寄语
肠道菌群作为人体内部生态的关键“守护者”,与癌症防治紧密交织,恰似为抗癌之战精心构筑的一道 “隐形防线”。通过科学有效的调节举措,不仅能为患者的整体健康状况筑牢根基、添砖加瓦,更能显著提升抗癌及免疫治疗的 “战斗力”,巧妙化解手术与放化疗带来的诸多副作用“难题”,肠道菌群调节也称为了继免疫细胞疗法、癌症疫苗之后的又一“抗癌新星”。比如上文提到的案例,就再次用数据佐证了粪菌移植在pMMR MSS结直肠癌患者免疫疗法中的巨大潜力,可改善对免疫检查点抑制剂(ICI) 的反应、提高患者的生存率。
最后小编温馨提示,如果癌症患者无法维持正常的营养需求和健康的体重时,需及时接受专业的营养支持,包括口服营养补充、肠外营养支持等。想了解粪菌移植、肠道菌群或定制益生菌更多讯息的患者,可将近期影像和病理检查结果、治疗经历等资料,提交至医学部,咨询权威的营养专家。
参考资料
[1]Cheng X,et al.Successful Treatment of pMMR MSS IVB Colorectal Cancer Using Anti-VEGF and Anti-PD-1 Therapy in Combination of Gut Microbiota Transplantation: A Case Report. Cureus. 2023 Jul 24;15(7):e42347.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10445052/












