癌症治疗组合拳怎么打?癌症疫苗联手放化疗等"六脉神剑",将癌细胞斩草除根
小编 2025-06-24
癌症疫苗联合放化疗等多种治疗方式综合治疗,将癌细胞斩草除根
临床数据表明,即便手术成功切除肿瘤,仍有部分患者会面临癌症复发,这通常与体内残留的微量癌细胞有关。而癌症疫苗正通过激活免疫系统对残留癌细胞的精准识别能力,为术后防复发提供了全新解决方案。
术后联合使用癌症疫苗与放化疗等手段,可通过「杀伤残余癌细胞 + 建立免疫记忆」的双重机制,显著降低复发转移风险。但遗憾的是,很多患者并不清楚如何通过联合治疗实现「1+1>2」的抗癌效果。下面小编就为大家全面盘点临床验证的联合治疗方案,让每一份抗癌努力都能收获更强大的力量。
全面盘点可与癌症疫苗携手抗癌的六大疗法,突破单药极限,实现1+1>2的抗癌突破
01、癌症疫苗联合CAR-T:卵巢癌、睾丸癌等
BNT211是一种靶向Claudin-6(CLDN6)的新一代CART细胞疗法,其联合治疗方案包含编码CLDN6的纳米颗粒mRNA疫苗CARVac。该疫苗可在抗原呈递细胞表面表达CLDN6,特异性刺激体内CAR-T细胞扩增。通过增强CAR-T细胞持久性与肿瘤杀伤力,实现「1+1>2」的协同抗癌效应。
BNT211的首次人体试验,共入组了44例复发/难治性晚期CLDN6阳性实体瘤(包括卵巢癌、睾丸癌等)患者,平均接受过4种治疗方案。将其分为两组:即联合治疗组(接受低剂量CLDN6 CAR-T细胞+CARVac疫苗联合治疗)、CAR-T单药治疗组。
结果显示:在38例可评估的患者中,总缓解率(ORR)为44.7%,疾病控制率(DCR)为73.7%。其中1例患者获得完全缓解(CR)。
02、癌症疫苗联合NK细胞疗法:卵巢癌
《Cureus》曾报道了一个应用“WT1-DC疫苗+NK细胞疗法联合治疗,让卵巢癌显著缩小”的案例。
该患者是一位IV期双侧卵巢癌、伴腹水及全身多处转移者。此前接受过化疗(紫杉醇+卡铂AUC5),但效果不佳,遂入组接受WT1-DC疫苗+NK细胞+纳武单抗联合治疗。
结果显示:治疗后,癌胚抗原(CEA)及CA125显著下降。腹部CT显示,在NK细胞治疗第56天后,腹水明显减少,提示腹膜播散情况改善。PET-CT显示,原发性肿瘤明显缩小,肺转移灶及腹膜播散灶消失,肝转移灶缩小(详见下图)。
▼该患者治疗前和治疗142天,PET-CT对比
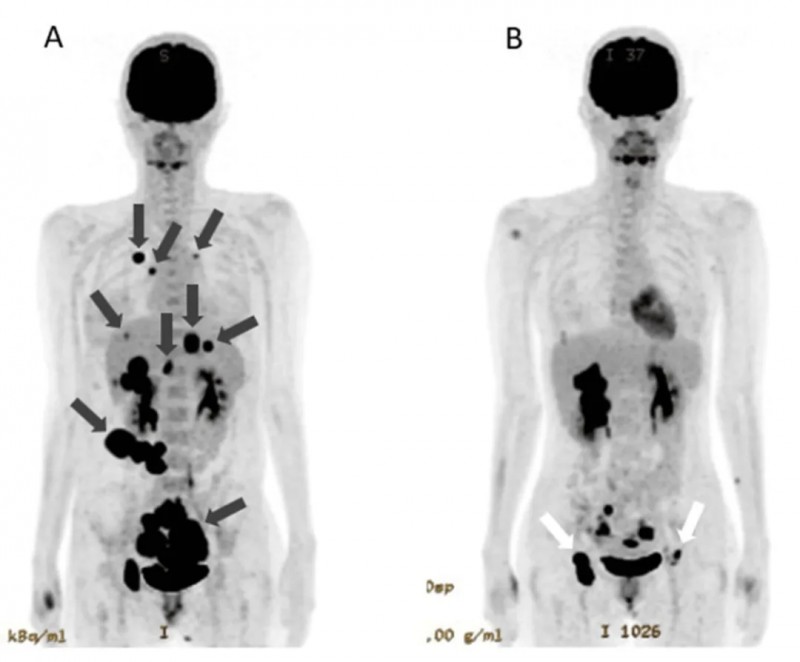
▲图源“Cureus”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
03、癌症疫苗联合化疗:胰腺癌
《癌症免疫治疗杂志》发表了一项“应用WT1肽脉冲成熟树突状细胞(DC)与多药化疗方案,联合治疗不可切除的胰腺导管腺癌(UR-PDAC)”的临床研究。
该研究共纳入10例不可切除的胰腺导管腺癌(UR-PDAC)患者,入组接受多药化疗方案(白蛋白结合型紫杉醇+吉西他滨)+WT1-DC疫苗治疗。
结果显示:有患者病灶均呈现退缩,降幅达0.0%~57.4%。其中7例(70%)达到部分缓解(PR),其余3例维持长期病情稳定(SD)。9例可评估患者中位无进展生存期(PFS)达2.23年,中位总生存期(OS)长达3.52年,远超传统化疗的1年生存期预期。
以一位转移性胰腺导管腺癌(M-PDAC)患者(WT1-DC-05)为例,治疗前后的CE-CT与18F-FDGPET/CT对比明显(详见下图)。
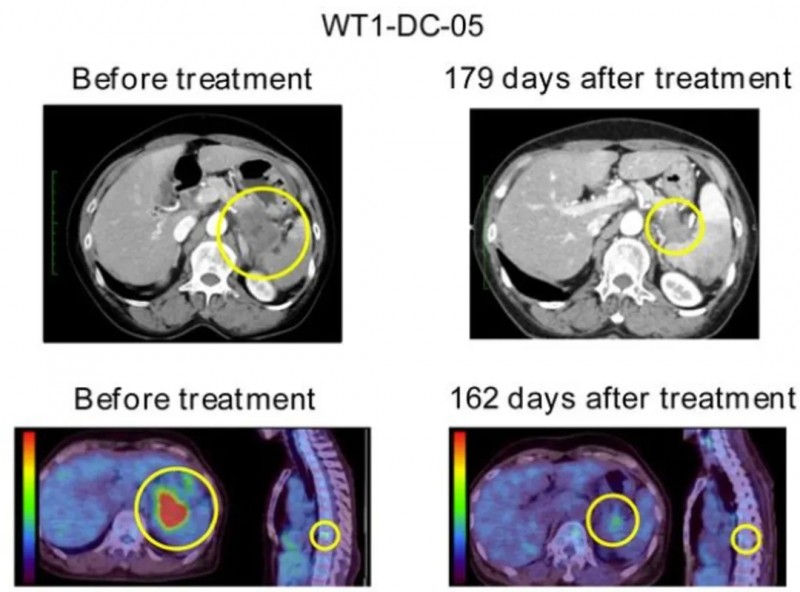
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
中国患者如何寻求癌症疫苗帮助
目前,癌症疫苗中临床疗效及预防复发效果较突出的是树突状细胞疫苗、mRNA癌症疫苗、古巴肺癌疫、个性化新抗原疫苗等。
其中,树突状疫苗在日本、德国等,用于临床辅助治疗多种癌症,包括皮肤癌、肝癌、肺癌、肾癌、乳腺癌等,是癌症患者的新希望!
而mRNA癌症疫苗正在针对肺鳞癌、肝癌、结直肠癌、黑色素瘤、食道癌、三阴性乳腺癌、头颈部肿瘤等多款恶性实体瘤,开展临床研究。
想寻求国内外癌症疫苗或其他治疗新技术帮助的患者,可先将治疗经历、病理报告、出院小结等资料,提交到医学部,进行初步评估或了解详细的入排标准。
04、癌症疫苗联合放疗——肠癌
《Cureus》期刊报道了一则应用DC疫苗联合放疗治疗肠癌的震撼案例:该患者是一位40岁男性,确诊晚期小肠癌,伴主动脉旁淋巴结转移及腹膜播散,对传统化疗完全耐药,并出现胆管与十二指肠梗阻,只能依靠胆管支架及中心静脉营养维持生命。因腹部癌痛剧烈,患者先接受 8Gy 单次姑息性调强放疗(IMRT),但疼痛控制无效,体能状态(PS)评分仅 4 分,终日依赖轮椅活动。
绝境中,患者入组WT1-DC联合放疗的创新治疗方案:在姑息性调强放疗(IMRT)放疗3周后,启动“α-Galcer-DC疫苗+纳武单抗+两次活化淋巴细胞”联合治疗,总疗程约 3 个月。
结果显示:治疗前后3个月腹部CT显示,小肠癌病灶显著减少(详见下图)。此外,血液检查显示,CA19-9肿瘤标志物水平显著下降,胆红素降低,肝功能明显改善。腹痛完全缓解,恢复流质饮食,体能评分从4分跃升至2分,可独立步行至医院,并自主完成如厕、洗澡等日常活动。
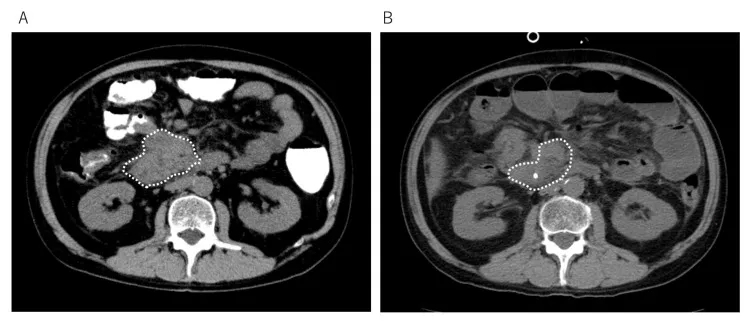
▲图源“Cureus”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
05、癌症疫苗联合免疫检查点抑制剂(ICI):胃癌
Neo-MoDC疫苗(载有新抗原的单核细胞衍生的树突状细胞疫苗)是我国自主研发的一款新型个性化癌症疫苗,能充分地调动机体的免疫系统,并促进T细胞富集,通过调动T细胞,对全身癌细胞进行猛烈攻击。
《PrecisionOncology》报道过一个“Neo-MoDC疫苗+免疫检查点抑制剂(ICI)联合治疗”的代表性案例。这是一位IV期转移性胃癌(BormannIII型)患者,在经历FOLFOX化疗及D2根治性远端胃切除术后,病情仍持续进展,出现腹膜及淋巴结转移。由于无法耐受进一步化疗,患者入组接受Neo-MoDC疫苗+ICI联合治疗。
结果显示:治疗2周后,患者恶性腹水完全消失;血清CA-125指标从治疗前的596U/ml骤降至64U/ml,标志着肿瘤活性得到迅速抑制,病情快速趋于稳定。初次接种疫苗后第231天,PET检查显示右侧卵巢转移灶近乎完全消退;联合治疗第389天,CT复查证实卵巢种植转移灶彻底消失(详见下图),达到影像学完全缓解(CR)。
截至数据统计时,患者病灶完全消退状态已持续25个月,远超晚期胃癌患者12-16个月的中位生存期,打破了传统治疗的生存极限。
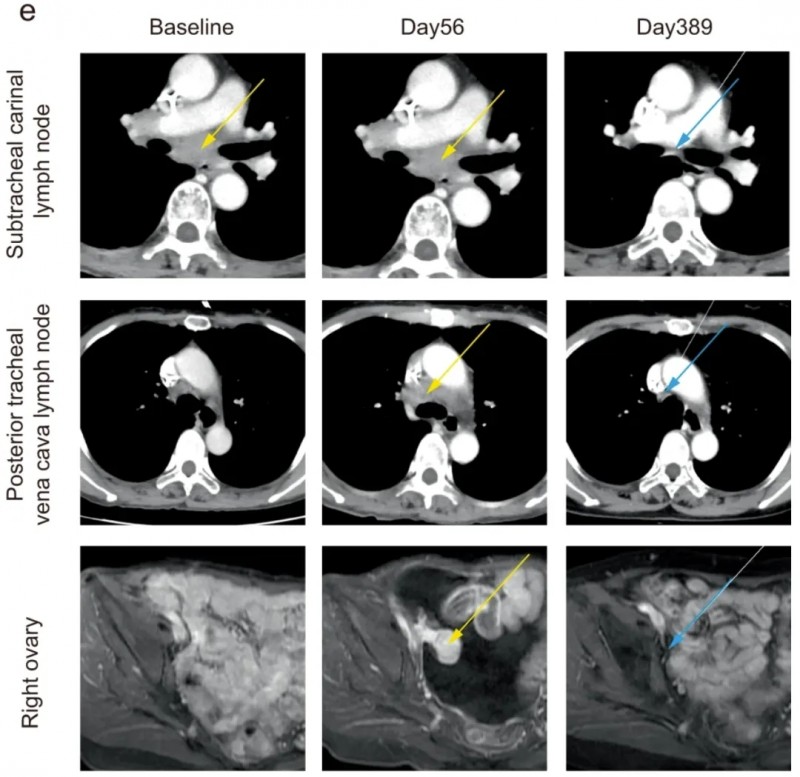
▲图源“npj”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
6、癌症疫苗联合PD-1抑制剂:肺癌
《细胞研究》曾报道一则突破性临床案例:一位69岁男性患者在年度体检中发现肺结节,经CT及PET-CT检查显示双肺与纵隔淋巴结存在多发高代谢病灶,病理活检确诊为晚期非小细胞肺癌(NSCLC),已失去手术机会。患者入组接受“KRASG12VmRNA疫苗+帕博利珠单抗”联合治疗方案。
结果显示:治疗3个周期后,右肺病灶基本消失,左肺病灶及纵隔淋巴结显著退缩(详见下图)。按RECIST1.1标准,该患者达到部分缓解(PR)。
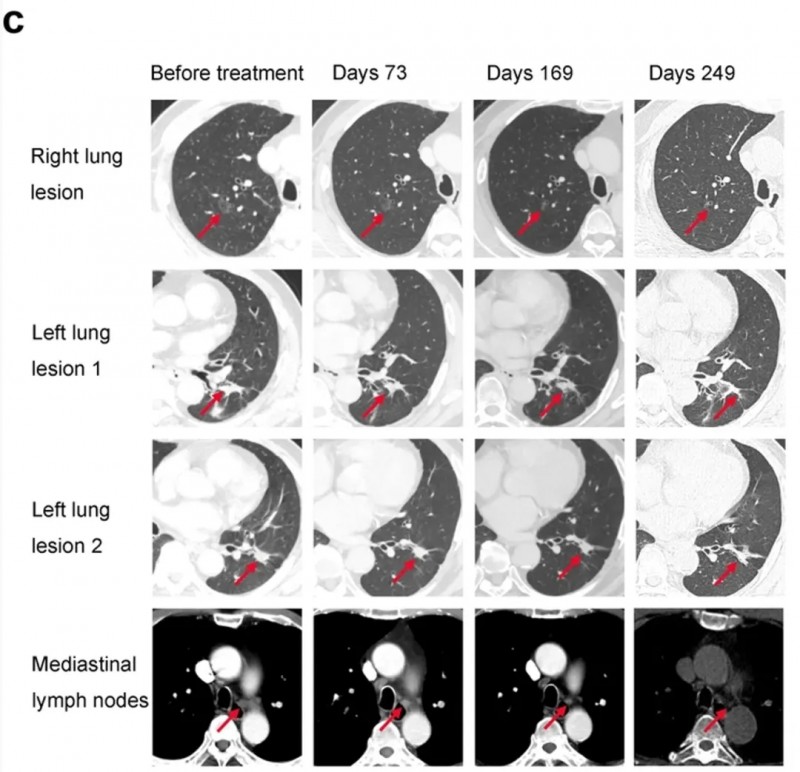
▲图源“Cell Research”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
07、癌症疫苗联合新抗原T细胞疗法:肝癌
《癌症免疫学研究》发表的II期临床研究(NCT03067493)首次探索了“个性化新抗原DC疫苗联合新抗原激活T细胞”疗法在肝癌术后防复发中的价值。研究纳入10例接受根治性手术或射频消融(RFA)的肝细胞癌(HCC)患者,术后接受DC疫苗+个体化新抗原免疫细胞联合治疗。
结果显示:50%(5例)患者在治愈性治疗后2年未出现肿瘤复发(详见下图A),中位无复发生存期(DFS)达18.3个月(95%CI:4.9-NA),较传统术后治疗显著延长。此外,免疫应答与生存强关联:有免疫应答患者的DFS显著长于无应答者(P=0.012),其中71.4%免疫应答者在2年内保持无复发,而无免疫应答患者均复发。
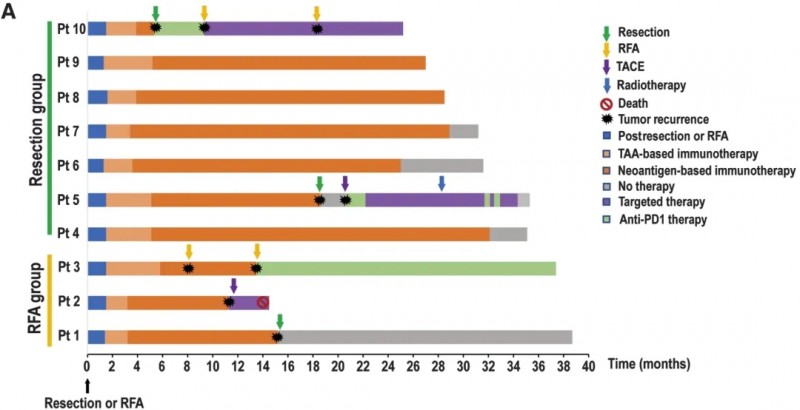
▲图源“Cancer Immunol Res”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
癌症疫苗经历几十载的发展,逐渐从基础研究阶段,转向了临床研究阶段,一次次突破技术壁垒,扩大应用范围,企图唤醒免疫系统,重新识别并杀伤癌细胞;同时产生免疫记忆反应,使免疫细胞发挥持久的保护作用。尤其考虑到最近的进展,癌症疫苗正迅速成为实体瘤治疗的潜力股!
但需要提醒大家的是,癌症作为一种高度复杂且突变频繁的疾病,仅依靠单一治疗手段,很难达到理想的治疗效果。目前,较为理想的治疗策略是在权威医院进行手术、放化疗等传统治疗的基础上,综合考虑患者的病情严重程度、个体体质差异、突变靶点特征以及经济状况等多方面因素,合理辅助靶向药物、免疫细胞治疗(如CAR-T、TCR-T、TIL细胞疗法、DC疫苗等)、质子治疗、电场疗法等新型治疗手段。通过这种多管齐下的治疗方式,能够巩固传统治疗的效果,降低肿瘤复发风险,提高患者的生存质量,并有效延长生存期。想了解癌症疫苗更多讯息的患者,可将治疗经历、近期病理报告等,提交至医学部,进行申请及评估。
参考资料
[1]Nagai H,et al.Late-Stage Ovarian Cancer With Systemic Multiple linkstases Shows Marked Shrinkage Using a Combination of Wilms' Tumor Antigen 1 (WT1) Dendritic Cell Vaccine, Natural Killer (NK) Cell Therapy, and Nivolumab. Cureus. 2024 Mar 22;16(3):e56685.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10960621/
[2]Koido S, Taguchi J, Shimabuku M, et al. Dendritic cells pulsed with multifunctional Wilms’ tumor 1 (WT1) peptides combined with multiagent chemotherapy modulate the tumor microenvironment and enable conversion surgery in pancreatic cancer[J]. Journal for Immunotherapy of Cancer, 2024, 12(10): e009765.
https://jitc.bmj.com/content/12/10/e009765
[3]Nagai H,et al.Combination of Radiation Therapy, Wim's Tumor 1 (WT1) Dendritic Cell Vaccine Therapy, and α-Galactosylceramide-Pulsed Dendritic Cell Vaccine Therapy for End-Stage Small Bowel Cancer. Cureus. 2024 Jul 20;16(7):e64972. doi: 10.7759/cureus.64972. Erratum in: Cureus. 2025 May 5;17(5):c220.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11259906/
[4]Guo Z,et al.Durable complete response to neoantigen-loaded dendritic-cell vaccine following anti-PD-1 therapy in linkstatic gastric cancer. NPJ Precis Oncol.2022 Jun 3;6(1):34.
https://www.nature.com/articles/s41698-022-00279-3
[5]Wang X,et al.Combination therapy of KRAS G12V mRNA vaccine and pembrolizumab: clinical benefit in patients with advanced solid tumors[J]. Cell Research, 2024, 34(9): 661-664.
https://www.nature.com/articles/s41422-024-00990-9
[6]Peng S,et al.Combination neoantigen-based dendritic cell vaccination and adoptive T-cell transfer induces antitumor responses against recurrence of hepatocellular carcinoma[J]. Cancer immunology research, 2022, 10(6): 728-744.
https://aacrjournals.org/cancerimmunolres/article/10/6/728/699035/Combination-Neoantigen-based-Dendritic-Cell












