50%患者生存超5年!肿瘤疫苗UV1获FDA快速通道资格,哪些抗癌疫苗值得关注?
全球肿瘤医生网 2021-10-27
抗癌抗肿瘤疫苗UV1获FDA快速通道资格,还有哪些癌症疫苗值得关注?
2013年《科学》杂志评出的年度十大科学突破排行榜中,免疫治疗居于榜首。近年来,免疫治疗一直都是国内外肿瘤治疗研究领域的火爆热点,可以称之为革命性的突破。
其中免疫检查点抑制剂疗法(如CTLA-4单抗、PD-1/PD-L1单抗等)已在黑色素瘤、肺癌、肾癌、鳞状细胞癌集肝癌等领域大放异彩,但并不是所有的癌症患者都对免疫检查点抑制剂产生反应。
说起疫苗,大家其实并不陌生,除了常见的乙肝疫苗、流感疫苗,到现在我们接种的新冠病毒疫苗。其实癌症疫苗也是免疫疗法的一种形式,通过刺激或恢复人体自身的免疫系统,来防止癌症发展或杀灭现有的肿瘤。癌细胞表面存在特殊的蛋白质,通过靶向这些蛋白质,免疫系统可以特异性地消除癌细胞,同时不伤害正常的细胞。
除了人乳头瘤病毒(HPV)疫苗是知名的预防性癌症疫苗外,目前全球首个也是目前唯一一个获得美国食品和药物管理局(FDA)批准的癌症治疗疫苗是Provenge(sipuleucel-T),这种疫苗第一次实现了利用患者自身的免疫系统攻击癌细胞的设想。
随访2年总生存率达80%!通用型癌症疫苗UV1获FDA授予快速通道资格
10月21日,FDA已批准通用癌症疫苗 UV1 与检查点抑制剂联合用于不可切除或转移性黑色素瘤患者的快速通道指定,作为PD-1单抗派姆单抗(K药,pembrolizumab)或CTLA-4单抗伊匹单抗(ipilimumab)的附加疗法。

FDA的决定基于两项UV1联合检查点抑制剂的I期临床试验数据:
在10月13日公布的数据中,UV1 联合 pembrolizumab 作为晚期黑色素瘤的一线治疗被证明是安全的,早期疗效数据很有希望!
1. 客观缓解率 (ORR) 为57%,其中30%的患者达到完全缓解 (CR) 或肿瘤完全消失。
2. 在24个月的随访中,80%的患者存活。如前所述,这些患者的中位无进展生存期为18.9个月。
3. 24 个月的随访数据与早期的单独 pembrolizumab 大规模研究相比具有优势,后者显示24 个月后的总生存率为58%,中位无进展生存率为 5.5~11.6个月。
在第二个队列中,90%的患者在一年后仍然存活,且肿瘤进展程度相似。
2021年5月发表在免疫学前沿的同行评审数据证明,UV1联合ipilimumab治疗晚期黑色素瘤安全且长期疗效显著,客观缓解率(ORR)为33%,5年总生存率(OS)达到50%。
目前,UV1联合检查点抑制剂正在进行四项II期临床试验,治疗不可切除或转移性黑色素瘤、卵巢癌、头颈部鳞状细胞癌和恶性胸膜间皮瘤。
数据还显示 UV1与Keytruda联合疗法不仅安全而且耐受性良好,不良事件主要限于低级效应,主要是注射部位反应。
UV1是一种肽基疫苗,可使T细胞扩张,从而有潜力增加针对肿瘤所有部位的免疫反应的广度和多样性。作为一种“通用型”治疗性癌症疫苗,UV1的疗效已在4项1期临床试验共82例患者中得到充分的验证,其安全性和耐受性也很良好。
无癌家园专家点评
此次研究尝试的UV1与Keytruda等免疫检查点抑制剂联合使用可以动员患者全身的免疫系统来对抗癌症,这对黑色素瘤患者和参与其他实体瘤方面更广泛临床开发项目的受试者来说是非常令人鼓舞的!
这次能够获得FDA授予快速通道资格,意味着该疫苗会受到FDA更多的关注,可以相对快速地获得FDA批准上市,让我们共同期待这款癌症疫苗可以造福更多的肿瘤患者。
UV1疫苗的最新临床进展有哪些
黑色素瘤
目前,代号为INITIUM的国际多中心的II期临床试验,招募了154例转移性恶性黑色素瘤患者,评估UV1联合免疫检查点抑制剂ipilimumab和nivolumab的一线治疗。
恶性间皮瘤
代号为NIPU的研究正在对118例晚期恶性胸膜间皮瘤(一种罕见的胸部肿瘤)患者进行二线治疗,将UV1与检查点抑制剂ipilimumab和nivolumab联合用于二线治疗。
这两项研究预计将在2022年公布主要终点数据。
非小细胞肺癌
在该研究中共招募了18名非小细胞肺癌患者,这些患者至少接受了二线化疗后病情稳定,之后接受疫苗作为维持治疗。每位患者平均接受了至少1个月的疫苗治疗。
截止到2020年6月,5年的里程碑时刻,总生存率为33%,中位无进展生存期为10.7个月。这意味着有1/3的患者接受这款疫苗后生存期超过5年,且安全性很好。
众所周知,既往对于没有检查点抑制剂治疗,仅接受二线化疗的患者,预期的5年生存率低于5%,从目前的的数据看,这款疫苗极大程度的提高了五年生存率。
CAR-T疗法和癌症疫苗有何本质区别?各有千秋,都是免疫治疗新希望
大家都知道,近期最火的莫过于免疫疗法中的CAR-T疗法,被称为广泛宣传的“抗癌明星”也不为过。
目前,随着阿基仑赛注射液、瑞基奥仑赛注射液前后在中国获批上市,癌症治疗领域火速掀起一阵“CAR-T热”。那么,CAR-T疗法和今天说讲的癌症疫苗有什么本质差别呢?这要从从人体免疫系统的基本构成和功能谈起。
免疫系统是保护身体健康的重要系统,需要借助两大武器实现上述目标,一种是体液免疫(或抗体免疫),一种是细胞免疫。分别通过特异性的抗体和杀伤性的免疫细胞攻击敌人。两者协同配合,抗体能发现和定位敌人,免疫细胞能到达抗体指定部位歼灭敌人,这种特殊的关系启发人们研发CAR-T疗法。
俗话说的好,“授人以鱼不如授人以渔”,同理适用于免疫疗法。一类是给患者补充缺乏的免疫武器,比如抗体和免疫细胞,这种给患者送“活鱼”的方法称为“被动免疫”,另一类方法是刺激患者自身免疫系统生产抗癌武器,这种教患者“捕鱼”的方法称为“主动免疫”。
所以,CAR-T疗法基本上是一种被动免疫。治疗后患者自身无法复制经人工改造的T细胞,而且是在短时间内增强患者的抗癌能力。
而癌症疫苗是利用癌症特异性的抗原,通过抗原来“培训”患者的免疫细胞,让患者自发地产生抗体和免疫细胞,是“主动免疫”也是“获得性免疫”。
两种疗法各有千秋,俗话说得好,黑猫白猫,抓到耗子的就是好猫,我们期待这两类疗法都能够迅猛良好地发展!
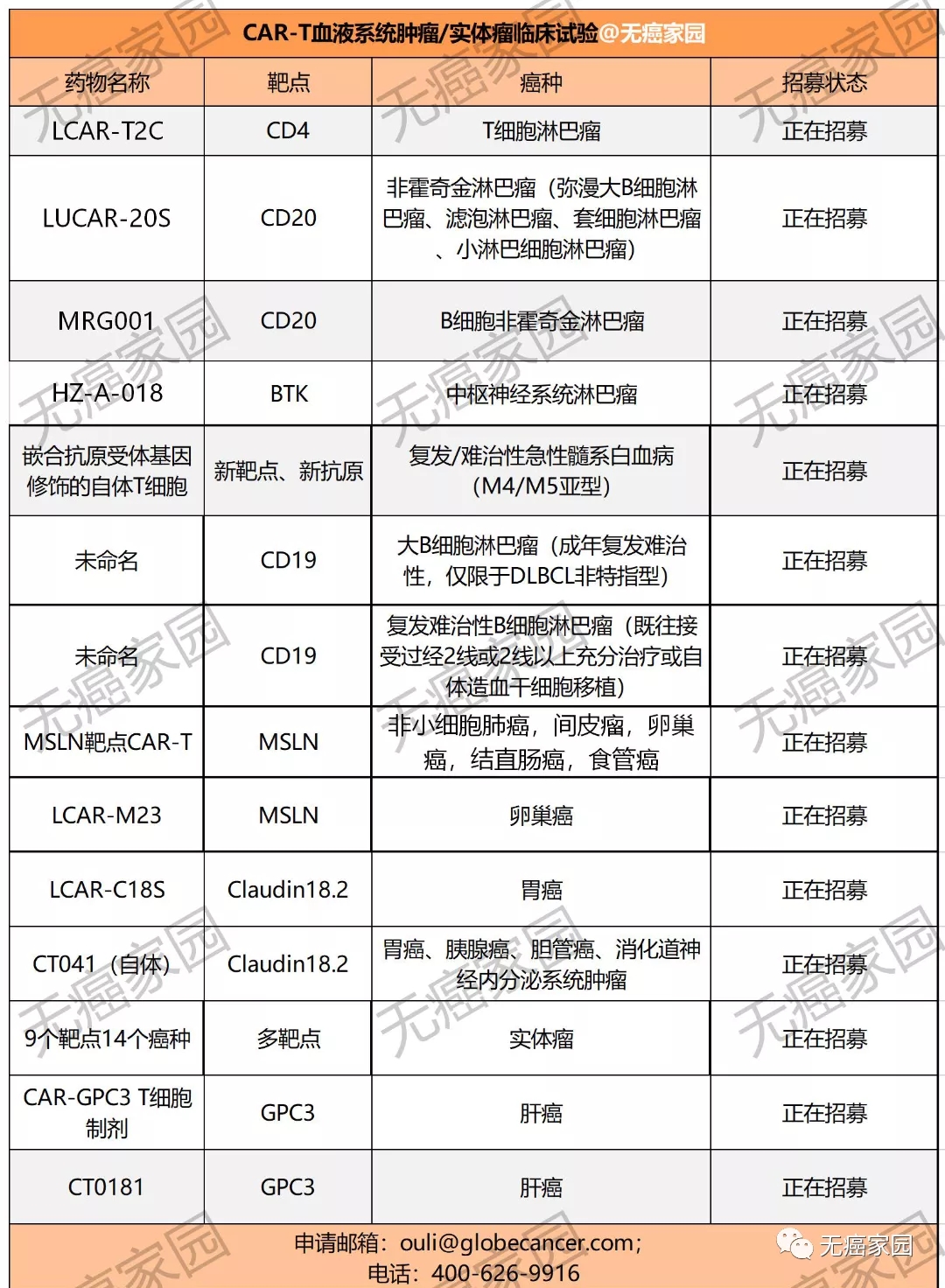
目前,我国还相关癌症疫苗的临床试验,但是有多款血液肿瘤和实体瘤的CAR-T疗法的临床试验正在招募中,有意向者可咨询医学部具体评估病情!
除了上述提到的通用型治疗性癌症疫苗UV1外,无癌家园小编再给各位癌友介绍其余8款治疗性癌症疫苗!
乳腺癌GP2疫苗实现5年无复发,迎来治愈新曙光
在2020年圣东安尼奥乳腺癌专题讨论会(SABCS)上展示了一张5年随访乳腺癌患者的结果图,顿时火遍整个癌友圈。这款被称为GP2的肿瘤疫苗,以一骑绝尘之势引起极大的轰动,5年随访,乳腺癌复发率为0%,让我们看到了肿瘤临床治愈的曙光!
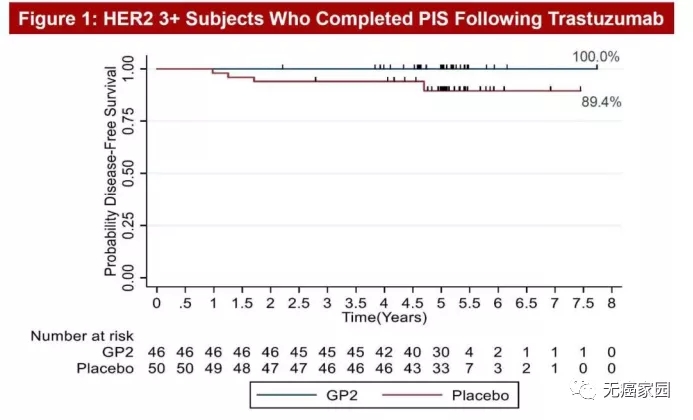
图中非常直观地能够看到,在5年随访后,46例HER2+患者接受GP2+GM-CSF(粒细胞-巨噬细胞集落刺激因子,FDA批准的免疫佐剂)治疗后,5年无病生存率(DFS)为100%,无一例复发!而单纯接受GM-CSF治疗的50例安慰剂患者的5年DFS发生率为89.4%。
GP2疫苗在无严重不良事件的情况下表现出良好的耐受性,并通过局部皮肤试验和免疫试验获得了强有力的免疫应答。
我们都知道第一个抗HER2靶向药物是曲妥珠单抗,随后HER2+乳腺癌的靶向治疗,迎来了更多的新进步。至今,全球治疗HER2+乳腺癌的药物至少获批了9款,包括有曲妥珠单抗、拉帕替尼、帕妥珠单抗、T-DM1、奈拉替尼、吡咯替尼、DS-8201、图卡替尼,还有2020年6月获批的曲妥珠单抗等。这些药物给HER2乳腺癌患者带来了明确的治疗效果和更多的治疗选择。
目前,全球已启动多项ARX788的临床研究,其中一项针对既往接受过赫赛汀等一线治疗方案失败的HER2阳性乳腺癌患者的临床研究正在招募患者,有意向参加的癌友可联系无癌家园医学部进行初步评估。
无进展生存期提高50%,AV-GBM-1疫苗给脑瘤患者带来新希望
据国外研究报道,原发性胶质母细胞瘤患者的标准治疗方法与不良的预后有关。研究人员推测,使用针对患者的疫苗进行辅助治疗可以通过增强免疫反应来帮助改善患者的预后。
6月8日,国外知名生物医学公司宣布其个性化癌症疫苗AV-GBM-1的II期临床试验数据公布,研究显示此款新型疫苗对延长新诊断的胶质母细胞瘤患者的中期总体生存期展现出极大的潜力。

该试验纳入的57例患者在6个月内接受8剂AV-GBM-1疫苗,在分析时,存活患者已完成治疗,并在入组后10.1~27.6个月内进行随访,中位无进展生存期为10.4个月,与具有里程碑意义的STUPP研究中的中位无进展生存期6.9个月相比,提高了约50%,为新诊断的胶质母细胞瘤患者建立了护理标准。
这表明在6.9个月时进展或死亡的风险降低了42%。中位生存期尚未达到,将在最终患者至少随访15个月后进行评估。
总体而言,患者的治疗耐受性良好,发生的所有不良事件均与疫苗无关。
AV-GBM-1是一种患者自体的特异性树突状细胞疫苗,旨在利用患者自身的免疫系统来寻找并消灭癌细胞这种树突细胞疫苗能够携带术后肿瘤组织中提取的特定抗原信息,注射后,将抗原信息传递给T细胞,激发起杀瘤活性。针对患者的自体疫苗虽然在逻辑上很复杂,但是是一种可行的方法,能够与替莫唑胺和放射治疗同时进行;也可以从化疗和放疗中恢复后再注射AV-GBM-1疫苗。患者如果能够成功进行单科白细胞收集,则年龄在70岁以下都有资格参加研究。
死亡风险降低45%,总生存期延长14.5个月,Provenge不负众望
2020年2月15日,在旧金山举行的2020年美国临床肿瘤学会泌尿生殖系统癌症研讨会(ASCO-GU 2020)上公布了首个现实世界(real-world)研究数据。这项研究中的闪耀之星就是名为Provenge的一款疫苗。
Provenge是首个在美国被批准用于治疗的疫苗,开创了癌症免疫治疗的新时代。这是一种自体细胞免疫疗法,于2010年4月29日获得美国FDA批准,用于治疗无症状或症状轻微的mCRPC,这项批复标志着20年的不懈努力终于取得成功。在美国,Provenge是FDA批准的唯一一种由患者自身免疫细胞制成的前列腺癌免疫疗法。截至目前,已有超过30000名男性患者被处方了Provenge治疗,该药在临床上已被证明可以延长晚期疾病男性的生命。
破解PD-1耐药,肺癌Tedopi疫苗震惊四座
2020年4月1日,OSE Immun otherapeutics公司重磅宣布其新型抗癌疫苗Tedopi在非小细胞肺癌的Ⅲ期临床试验(代号为Atalante 1)取得了阳性结果,入组的所有患者在免疫检查点抑制剂(PD-1)耐药或失败后,二线或三线使用Tedopi疫苗,一年的总生存率达到46%,远超预设的25%!
一位54岁的晚期肺癌患者在经过5次的新型肺癌疫苗注射后,肿瘤就迅速萎缩(从39毫米降至23毫米),截止报道时,生存期已经超过20.6个月,目前仍在随访中。
2年无病生存率73%,TLPLDC疫苗治疗黑色素瘤疗效强劲
在2020年ASCO-SITC临床免疫肿瘤学会议上公布了TLPLDC疫苗治疗黑色素瘤IIb期临床试验的亚组分析结果。
此项试验共纳入144例III期(晚期)和IV期(转移性)黑色素瘤已切除的患者,而在此前早已公布了主要的分析数据显示:
在遵循临床研究方案(PT)人群分析中,与安慰机组相比,TLPLDC治疗组24个月无病生存率显著提高(62.9% vs 34.8%),表明疾病复发的相对风险降低了近50%。
在意向性治疗(ITT)人群分析中,TLPLDC治疗组和安慰剂组在24个月无病生存方面无显著性改善(38.5% vs 27%),但在该分析中,24个月总生存率(OS)的改善趋势更强(86.4% vs 75.1%)。
头颈癌:疾病控制率90%!mRNA-4157疫苗曙光初现
首先介绍的这款疫苗就是前段时间在医疗圈刷屏的新型个体化癌症疫苗mRNA-4157,最新公布的一期临床试验数据非常让人振奋,对恶性肿瘤的疾病控制率高达90%,超过了很多已上市的靶向和免疫治疗药物,值得期待。
2020年11月11日,Moderna公司公布了mRNA-4157联合Keytruda能够缩小多种晚期实体肿瘤病灶。
在10例HPV阴性的头颈部鳞状细胞癌患者中,总缓解率为50%:2例完全缓解和3例部分缓解。同时,4例患者疾病稳定,疾病控制率(DCR)达到90%。
与单独使用PD-1抑制剂相比,它具有明显的优势:中位无进展生存期(mPFS)为9.8个月。
即使与Keytruda / chemo组合(一线治疗的标准护理)相比,结果也令人满意,该组合产生的总缓解率为36%,中位无进展生存期为4.9个月。
生存期明显延长,ilixadencel疫苗进军肾癌一线治疗
ilixadencel(伊利沙定)是一款同种异体树突状细胞(DC)疫苗。根据最新的全球性II期MERECA临床试验(NCT02432846)数据显示,ilixadencel联合靶向抗癌药舒尼替尼(索坦,通用名:sunitinib)一线治疗新诊断的晚期转移性肾细胞癌(mRCC)患者,与单独采用舒尼替尼治疗的患者相比,总缓解率提高一倍,完全缓解率更高,缓解更加持久!
截至2020年8月的最新数据
(1) ilixadencel组的中位总生存期尚未达到,对照组的中位生存期为25.3个月。
(2) ilixadencel组的存活患者比例为43%(24/56),而对照组为33%(10/30)。在此次随访中,ilixadencel组的5例完全缓解者(CR)仍然存活,正如先前报道的,对照组中的1例完全缓解者在第一次随访期间死亡。
去年5月,美国食品和药物管理局(FDA)授予了ilixadencel再生医学先进疗法(RMAT)资格。
无癌家园专家进一步分析道,ilixadencel联合舒尼替尼一线治疗晚期肾癌,可以大大提高治疗的有效率,患者的总生存率和完全缓解率,并且更加安全。这款新型的疫苗潜力无限,共针对六种癌症类型,包括肾癌、肝癌、胃肠道间质瘤、头颈部肿瘤、非小细胞肺癌和胃癌等实体肿瘤,我们期待进一步的临床数据,希望这款疫苗能早日上市造福患者。
死亡风险降低62%,DCVAC/OvCa疫苗给卵巢癌患者带来福音
DCVAC树突疫苗是一种活性细胞免疫治疗,其使用自身树突细胞为每个患者生产和定制,试图诱导针对肿瘤抗原的免疫反应。
在2019年第50届妇科肿瘤学会(SGO)年会上,一项二期临床试验SOV02最终结果公布:对复发,铂敏感,上皮卵巢癌患者使用基于树突状细胞的免疫疗法DCVAC/OvCa添加到标准卡铂和吉西他滨方案,可以使晚期复发的卵巢癌患者总生存期(OS)延长一年多。而且DCVAC/OvCa将卵巢癌二线治疗的死亡风险降低了62%。总生存期(OS)显着增加13.4个月。中位数无进展生存率(mPFS)增加了1.8个月。即将开展全球III期研究。
更让人惊喜的是,这款疫苗让一名患者奇迹般地获得了康复。这名患者46岁,罹患IV期卵巢癌,一般而言,这类患者的预后非常差。之前,她已经接受了5轮化疗,但无济于事。也许是抱着死马当活马医的态度,她接受了抗癌疫苗的治疗,并在2年时间里使用了28次个体化抗癌疫苗。在治疗期间,她的癌症得到了很好的控制。而在停止治疗后,她已经5年没有复发,也就是“临床治愈”!
未来可期!细胞免疫疗法是攻克癌症的终极武器
除了上述提到的细胞免疫疗法外,还有:
TCR-T疗法:主要机制是向普通T细胞中引入新的基因,使得改造过的T细胞能够表达有效识别肿瘤细胞的TCR(T cell receptor,T细胞抗原受体),从而引导T细胞杀死肿瘤细胞。
TILs疗法:简单点讲就是将手术切除的肿瘤组织中的淋巴细胞分离纯化,挑选出其中能特异性抗癌的淋巴细胞,扩增活化后回输。
CTL疗法(利用癌细胞特有的、正常细胞上没有或者含量很低的蛋白质做诱饵,把外周血中那“万里挑一”的真正能抗癌的淋巴细胞,挑选出来,然后在体外进一步改良和扩增,然后回输给患者)、其他癌症疫苗等也正在不断改进技术,力求早日攻克癌症。
随着CAR-T疗法的获批上市,我国已经正式进入细胞免疫治疗的元年!未来也将有新抗原疫苗试验招募更多的晚期患者测试疫苗的疗效,无癌家园会密切关注相关研究报道。
小编相信,在不久的将来,人类利用接种疫苗来预防癌症、战胜癌症不再是梦!












