终于盼到了!2026年13款抗癌新药有望获批,从CAR-T到ADC,覆盖肺癌、胃癌等十大癌种
小编 2026-01-09
终于盼到了!2026年13款抗癌新药有望获批,从CAR-T到ADC,覆盖肺癌、胃癌等十大癌种
2026年新年伊始,抗癌领域喜讯频传——多款潜力十足的创新抗癌新药接连提交上市申请。这预示着,2026年国内有望迎来一大批突破性抗癌新药的集中获批,覆盖抗体偶联药物(ADC)、双特异性抗体、BCL-2抑制剂、CAR-T细胞疗法等多个前沿治疗方向。届时,这些全新疗法将为无数在黑暗中苦苦等待的肿瘤患者带来新的治疗选择与希望曙光,助力改写抗癌战局的艰难态势!
为帮助广大癌友坚定战胜癌症的信心,小编第一时间精心汇总了“2026有望获批上市的抗癌新药榜单”(注:下列信息仅供参考,具体用药方案需遵循医嘱,也可联系医学部,进行初步评估)。
2026有望获批的十三款抗癌新药抢先看
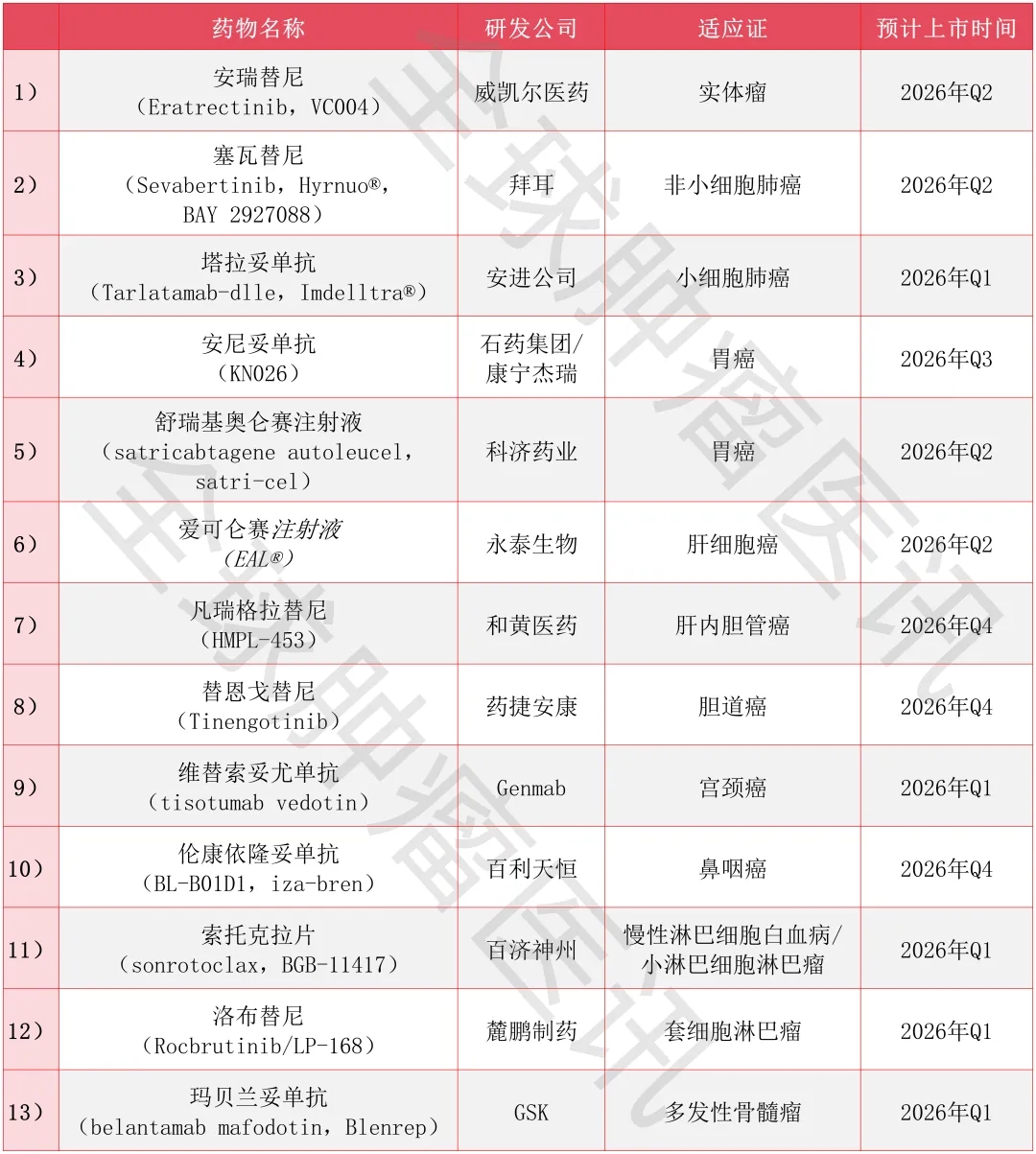
安瑞替尼(Eratrectinib,VC004)
药品简介
①药物名称:安瑞替尼(Eratrectinib,VC004)。
②研发公司:威凯尔医药。
③适应证:实体瘤。
④预计上市时间:2026年Q2。
药物详情
安瑞替尼胶囊(VC004胶囊)是我国自主研发的新一代泛癌种TRK酪氨酸激酶抑制剂(TKI),核心优势在于可有效克服NTRK融合阳性癌症对第一代TRKTKI的获得性耐药,为患者带来更持久的疗效。
2025年7月4日,该药的上市申请获CDE正式受理,并被纳入优先审评通道,拟适应症明确为携带NTRK融合基因的成人及12岁以上青少年实体瘤患者,具体包括:局部晚期或转移性疾病患者、手术切除可能引发严重并发症的患者,以及无满意替代治疗方案或既往治疗失败的患者,预计2026年第二季度(Q2)获批。
其首次I/II期人体临床试验(NCT04614740)共纳入51例局部晚期或转移性实体瘤患者。
研究结果显示,依据RECISTv1.1评估标准:在26例既往未接受过TRKTKI治疗的患者中,确认客观缓解率达65.4%(95%CI:44.3%-82.8%),确认+未确认客观缓解率为80.8%(95%CI:60.6%-93.4%),其中1例患者靶病灶完全消失。3例既往接受TRKTKI治疗进展的患者中,2例实现肿瘤缩小,1例达到39.6%的部分缓解。此外,8例基线脑转移患者中,2例颅内病灶分别缩小48.4%和25%,2例患者非靶病灶在治疗4个月后完全消失。目前,中位缓解持续时间(DoR)与中位无进展生存期尚未达到,但23.8%的TRKTKI初治患者缓解持续时间≥12个月,最长可达27.6个月。
· NTRK突变:横跨肺癌,肠癌,肉瘤等十大癌种 ·
NTRK突变存在于几乎所有类型的实体瘤。其中部分癌种检出率很高,如在分泌性乳腺癌、唾液腺癌成年患者以及分泌性乳腺癌、婴儿纤维肉瘤、先天性肾癌儿童患者中检出率在75%以上;部分癌种检出率较高,在甲状腺癌、胃肠道间质瘤、神经胶质瘤及部分黑色素瘤患者中检出率约为5%~25%;部分癌种,如在结直肠癌、胰腺癌、胆管癌、肺癌、肉瘤、脑瘤等癌种中也有检出,检出率相对较低,一般在1%~5%左右。NTRK抑制剂在靶向治疗干预中的作用日益突出,因此识别这些融合基因至关重要。
做了基因检测的病友可以拿出报告看看,一旦存在NTRK突变,可联系医学部,初步评估是否有机会接受国内新药治疗,看不懂的病友也可提交到医学部解读报告。
塞瓦替尼(BAY 2927088)
药品简介
①药品名称:塞瓦替尼(Sevabertinib,BAY 2927088,Hyrnuo®)。
②研发公司:拜耳。
③适应证:非小细胞肺癌。
④预计上市时间:2026年Q2。
药物详情
塞伐替尼(通用名:Sevabertinib,研发代号:BAY2927088)是拜耳研发的口服小分子HER2选择性酪氨酸激酶抑制剂(TKI),此前已获美国FDA突破性疗法认定,适应症为既往接受过全身治疗的不可切除或转移性HER2突变型非小细胞肺癌(NSCLC)成人患者。
2025年7月23日,该药的上市申请正式获CDE受理,并被纳入优先审评通道,拟适应症明确为携带HER2(ERBB2)激活突变且既往接受过一种全身性治疗的晚期NSCLC成人患者,预计2026年第二季度(Q2)在中国获批。其关键I/II期SOHO-01试验(NCT05099172)数据显示显著疗效:
①队列D(n=44,未接受过HER2靶向治疗):客观缓解率(ORR)达70.5%(95%CI:54.8-83.2),疾病控制率(DCR,缓解或病情稳定≥12周)为81.8%,中位缓解持续时间(DoR)8.7个月(95%CI:4.5-无法估计(NE))。
②队列E(n=34,既往接受过HER2靶向抗体-药物偶联物治疗):ORR为35.3%(95%CI:19.7-53.5),DCR为52.9%,中位DoR9.5个月(95%CI:4.1-NE)(详见下图)。
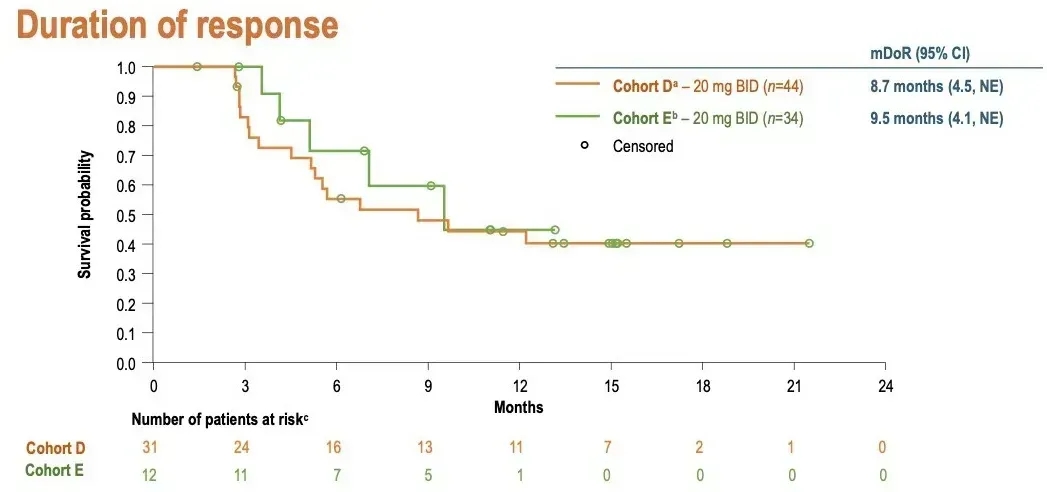
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
塔拉妥单抗
药品简介
①药物名称:塔拉妥单抗(Tarlatamab-dlle,Imdelltra®)。
②研发公司:安进公司。
③适应证:广泛期小细胞肺癌。
④预计上市时间:2026年Q1。
药物详情
塔拉妥单抗是安进研发的首款DLL3靶向双特异性T细胞接合剂(BiTE®),也是目前唯一获批用于侵袭性肺癌的DLL3靶向BiTE疗法,更是小细胞肺癌治疗领域的重要里程碑。2025年7月,该药的上市申请获NMPA受理并纳入优先审评,预计2026年第一季度(Q1)获批。
在一项针对既往接受过治疗的小细胞肺癌患者的II期临床试验中,共纳入220例既往接受过中位两线治疗的患者接受塔拉妥单抗治疗。研究结果显示如下:
①10mg剂量组:客观缓解率达40%(97.5%CI:29%~52%),中位无进展生存期为4.9个月(95%CI:2.9~6.7),9个月总生存率估计值为68%。
②100mg剂量组:客观缓解率为32%(97.5%CI:21%~44%),中位无进展生存期为3.9个月(95%CI:2.6~4.4,详见下图B),9个月总生存率估计值为66%。
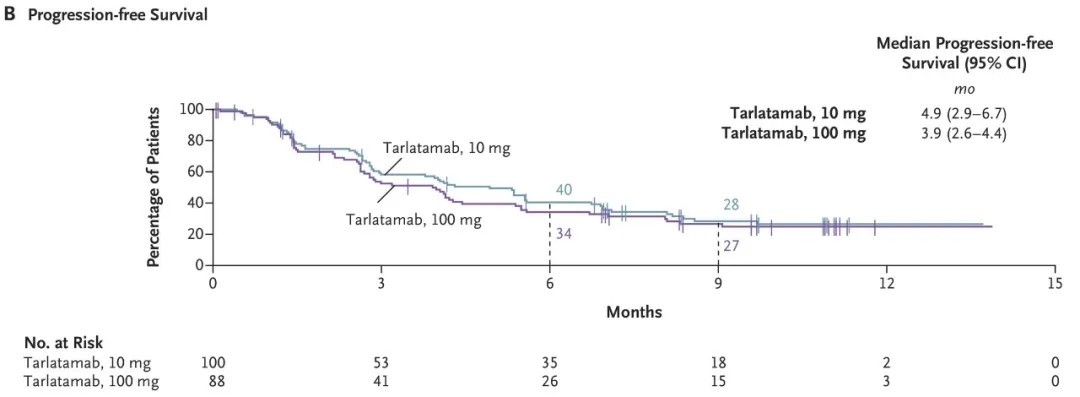
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
安尼妥单抗
药品简介
①药物名称:安尼妥单抗(KN026)。
②研发公司:石药集团/康宁杰瑞。
③适应证:胃癌。
④预计上市时间:2026年Q3。
药物详情
安尼妥单抗(KN026)是康宁杰瑞自主研发的一款新型HER2靶向双特异性抗体,可同时结合HER2的两个非重叠表位,实现对HER2信号通路的强效阻断。
2025年9月12日,该药的上市申请获CDE受理,并被纳入优先审评通道,联合化疗用于至少接受过一种系统性治疗失败的HER2阳性局部晚期、复发或转移性胃/胃食管结合部腺癌。据悉它是首个申报上市的国产HER2双抗,预计2026年第三季度(Q3)获批。
在“KN026治疗晚期HER2表达胃癌或胃食管交界处癌”的II期临床试验中,共纳入45例患者并接受至少一剂KN026治疗,其中HER2高表达组27例、低表达组14例、无表达组4例。研究结果显示:
①HER2高表达组:客观缓解率(ORR)达56%(95%CI:35%–76%),中位缓解持续时间为9.7个月(95%CI:4.2个月–无法评估),中位总生存期为16.3个月(95%CI:11.0–无法评估(NE))。
②HER2低表达组:客观缓解率(ORR)为14%(95%CI:2%–43%),中位总生存期为9.6个月(95%CI:3.5–14.9)(详见下图)。
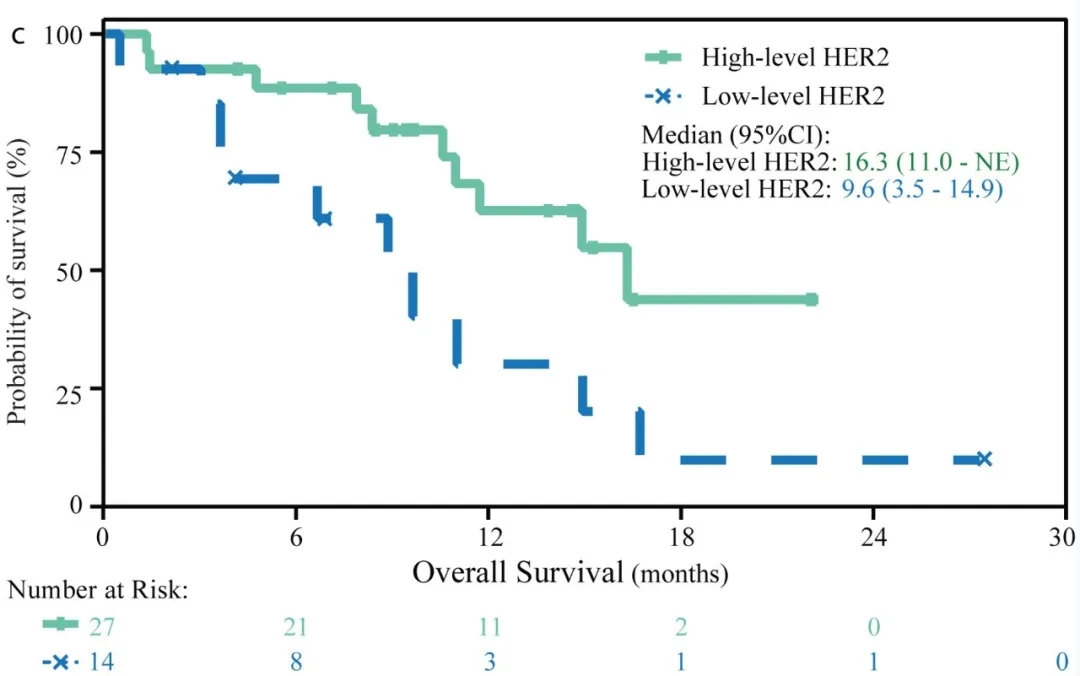
▲图源“EJC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
舒瑞基奥仑赛
药品简介
①药物名称:舒瑞基奥仑赛注射液(satricabtagene autoleucel,简称“satri-cel”)。
②研发公司:科济药业。
③适应证:胃癌。
④预计上市时间:2026年Q2。
药物详情
舒瑞基奥仑赛注射液(satri-cel)是科济药业研发的自体CAR-T细胞疗法,靶向肿瘤相关蛋白Claudin18.2,拟用于治疗Claudin18.2阳性实体肿瘤。
2025年6月26日,该药的上市申请正式获国家药品监督管理局受理,拟适应症为Claudin18.2表达阳性、至少二线治疗失败的晚期胃/食管胃结合部腺癌患者。该申请已被纳入优先审评通道,凭借突破性的临床数据,预计2026年第二季度(Q2)在中国获批。
在2025ASCO年会上,重磅公布了该药的关键随机2期对照试验(CT041-ST-01)数据。结果显示:satri-cel治疗组较标准治疗组(TPC)在核心疗效指标上展现出显著优势:中位无进展生存期(PFS)为3.25个月(95%CI:2.86–4.53),远超TPC组的1.77个月(95%CI:1.61–2.04)(详见下图A);中位总生存期(OS)达7.92个月(95%CI:5.78–10.02),较TPC组的5.49个月(95%CI:3.94–6.93)提升超30%(详见下图B)。在肿瘤控制方面,satri-cel组确诊客观缓解率(ORR)为22%(23/104,95%CI:15–31),疾病控制率(DCR)达63%(95%CI:52–72);而TPC组ORR仅为4%(2/52,95%CI:0–13),DCR仅25%(95%CI:14–39),两组数据差异显著。
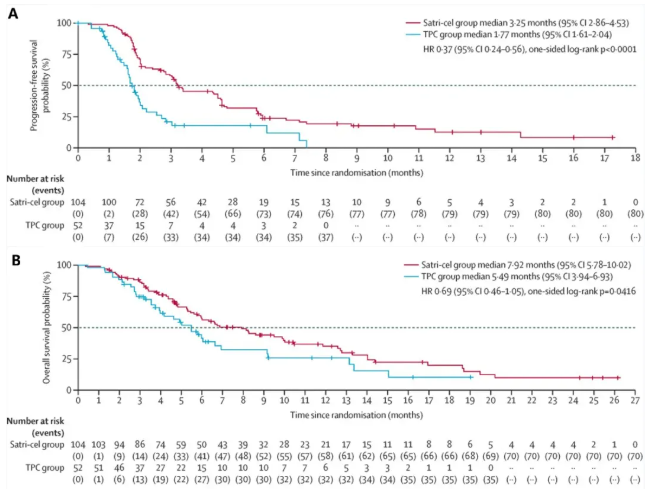
▲图源“The Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,研究中一项典型案例展现了独特的治疗响应过程:患者在输注satri-cel后第2周,肝脏病灶较基线有所增大;但在后续持续随访中,病灶逐步缩小,至输注后第26周时,已显著小于基线水平(详见下图)。
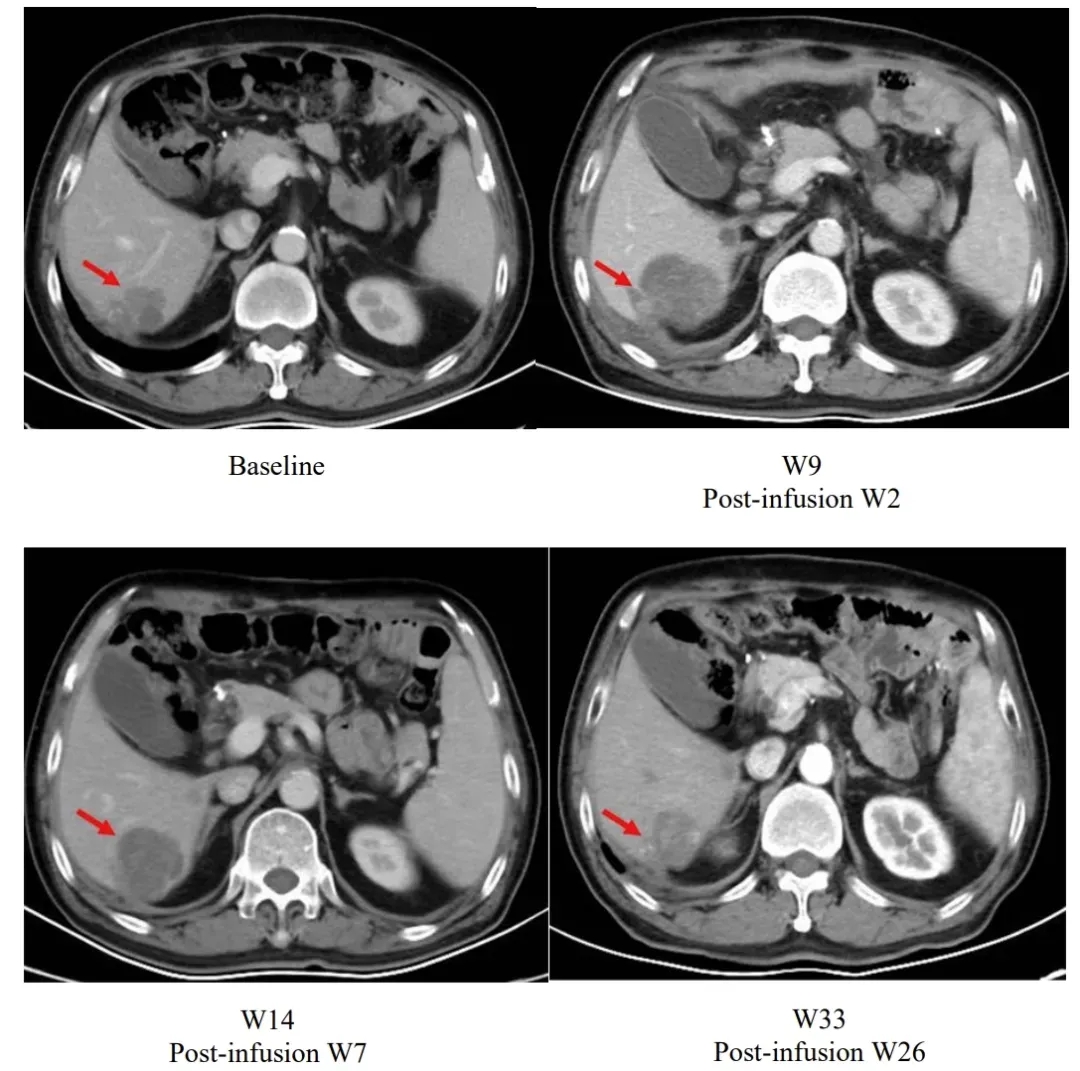
▲图源“The Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
好消息是,目前有多款CAR-T临床实验正在火热招募中,主要针对胰腺癌、胃癌、肝癌、肺癌、乳腺癌、结肠癌、卵巢癌、多发性骨髓瘤、白血病、淋巴瘤等癌种。想寻求CAR-T疗法帮助的患者,可将将近期影像及病理检查报告、治疗经历等,提交至医学部,进行初步评估。
爱可仑赛
药品简介
①药物名称:爱可仑赛注射液(EAL®)。
②研发公司:永泰生物。
③适应证:肝细胞癌。
④预计上市时间:2026年Q2。
药物详情
爱可仑赛注射液是永泰生物自主研发的扩增活化淋巴细胞(EAL)疗法,也是国内首款申报上市的实体瘤细胞免疫治疗药物。其核心作用机制为体外激活扩增患者自身抗肿瘤淋巴细胞,回输后增强机体免疫监视能力,精准清除术后微小残留病灶(MRD),从根源上降低肝癌复发风险。
2025年3月31日,该药的上市申请正式获CDE受理,并同步纳入优先审评通道,拟适应症为原发性肝细胞癌根治术后高复发风险患者的辅助治疗,预计2026年Q2在中国获批,有望成为全球首个肝癌术后辅助细胞免疫治疗药物,填补肝癌术后无有效免疫预防方案的临床空白。
凡瑞格拉替尼
药品简介
①药物名称:凡瑞格拉替尼(HMPL-453)。
②研发公司:和黄医药。
③适应证:肝内胆管癌。
④预计上市时间:2026年Q4。
药物详情
凡瑞格拉替尼(研发代号:HMPL-453)是和黄医药研发的新型高选择性FGFR1/2/3酪氨酸激酶抑制剂。2025年12月24日,该药的上市申请获CDE正式受理,并被纳入优先审评通道,拟适应症为既往接受过系统性治疗、且存在FGFR2融合或重排的晚期、转移性或不可手术切除的肝内胆管癌成人患者。
其关键II期临床研究(NCT04353375)共纳入25例肝内胆管癌患者,中位年龄51岁(范围28-76岁),所有患者均接受凡瑞格拉替尼治疗。
结果显示:在22例可评估疗效的患者中(队列112例、队列210例),所有患者均完成至少一次基线后肿瘤评估。经研究者评估,最佳总体疗效数据亮眼:7例(31.8%)患者达到确认的部分缓解,12例(54.5%)患者实现病情稳定,疾病控制率(DCR)高达86.4%。
替恩戈替尼(Tinengotinib)
药品简介
①药物名称:替恩戈替尼(Tinengotinib)。
②研发公司:药捷安康。
③适应证:胆道癌。
④预计上市时间:2026年Q4。
药物详情
替恩戈替尼是一款创新多靶点小分子激酶抑制剂,可通过靶向肿瘤细胞与改善肿瘤微环境的双重作用发挥抗肿瘤效果。2025年12月19日,该药的上市申请获CDE受理并纳入优先审评通道,拟适应症为既往至少接受过一种系统性治疗及FGFR抑制剂治疗的晚期、转移性或不可手术切除的胆管癌成人患者。
该药的II期临床试验(NCT04919642),共纳入55例中位年龄61岁(IQR56-68岁)胆管癌患者,随机分至A1(n=18)、A2(n=11)、B(n=13)、C(n=13)四队列。
结果显示:51例可评估患者中,各队列客观缓解率(ORR):A1组6.3%(95%CI0.2–30.2,1例确认部分缓解)、A2组30.0%(6.7–65.3,3例)、B组23.1%(5.0–53.8,3例)、C组0%。综上,替恩戈替尼或对FGFR抑制剂治疗后进展的FGFR2融合型胆管癌有效,在其他FGFR改变患者中亦观察到抗肿瘤活性。
维替索妥尤单抗(tisotumab vedotin)
药品简介
①药物名称:维替索妥尤单抗(tisotumab vedotin)。
②研发公司:Genmab。
③适应证:宫颈癌。
④预计上市时间:2026年Q1。
药物详情
维替索妥尤单抗(tisotumabvedotin)是Genmab原研的抗体偶联药物,由靶向组织因子(tissuefactor)的人源化单抗、可降解连接子及微管抑制剂MMAE组成。在全球18款同靶点在研ADC中,其为首款且唯一获批品种,已在美欧日等多地上市;国内于2025年3月提交上市申请,预计2026年Q1获批。
一项针对复发性宫颈癌二线/三线治疗的III期研究(NCT04697628)纳入502例患者,随机分至维替索妥尤单抗组与化疗组。结果显示:维替索妥尤单抗组核心疗效指标显著优于化疗组。
①客观缓解率(ORR):17.8% vs 5.2%(OR=4.0,95%CI:2.1-7.6,双侧P<0.001)。
②总生存期(OS):中位11.5个月(95%CI:9.8-14.9) vs 9.5个月(95%CI:7.9-10.7),死亡风险降低30%(HR=0.70,95%CI:0.54-0.89,双侧P=0.004)(详见下图)。
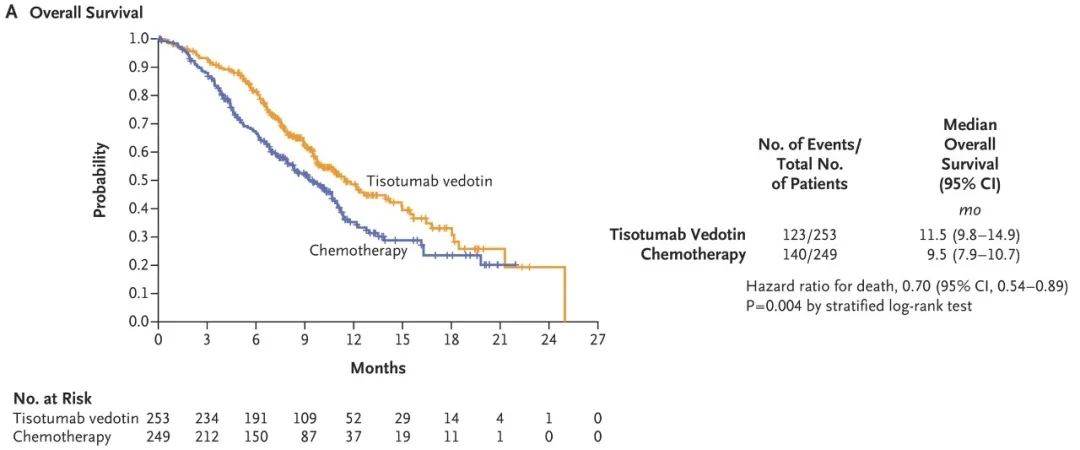
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
③无进展生存期(PFS):中位4.2个月(95%CI:4.0-4.4) vs 2.9个月(95%CI:2.6-3.1),疾病进展/死亡风险降低33%(HR=0.67,95%CI:0.54-0.82,双侧P<0.001);6个月无进展生存率30.4% vs 18.9%(详见下图)。
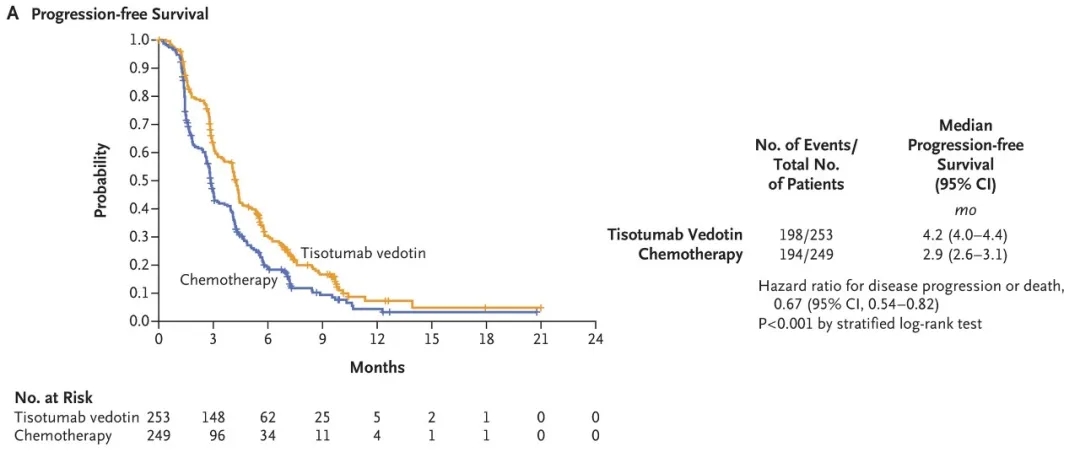
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
伦康依隆妥单抗(BL-B01D1)
药品简介
①药物名称:伦康依隆妥单抗(BL-B01D1,iza-bren)。
②研发公司:百利天恒。
③适应证:鼻咽癌。
④预计上市时间:2026年Q4。
药物详情
伦康依隆妥单抗(BL-B01D1,iza-bren)是百利天恒自主研发的全球首创EGFR×HER3双抗ADC,也是首个完成III期研究且唯一申报上市的双抗ADC。其靶向EGFR及具EGFR抑制剂耐药治疗潜力的HER3,凭借双靶点协同、DAR值8、自主喜树碱衍生物毒素ED04及可裂解连接子设计,在多线治疗失败实体瘤中疗效显著、安全性可控。
2025年11月21日,该药用于既往经PD-1/PD-L1单抗及至少两线化疗(至少一线含铂)失败的复发/转移性鼻咽癌的上市申请获CDE受理并纳入优先审评,食管鳞癌适应症拟纳入优先审评,预计2026年Q3中国获批。
III期关键研究(BL-B01D1-303,NCT06118333)显示:伦康依隆妥单抗组客观缓解率(ORR)54.6%,显著高于TPC组27.0%(OR=3.33,P<0.0001);中位缓解持续时间(DoR)8.51个月 vs 4.76个月;中位无进展生存期(PFS)8.38个月 vs 4.34个月(HR=0.44,95%CI:0.32-0.62)。
索托克拉
药品简介
①药物名称:索托克拉片(sonrotoclax,BGB-11417)。
②研发公司:百济神州。
③适应证:慢性淋巴细胞白血病/小淋巴细胞淋巴瘤。
④预计上市时间:2026年Q1。
药物详情
索托克拉片(sonrotoclax,BGB-11417)是百济神州自研的一款BCL2抑制剂。2025年4月,其用于既往接受过治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)的上市申请获CDE受理并纳入优先审评;同年5月,第二项适应症——既往接受过抗CD20及BTKi治疗的套细胞淋巴瘤(MCL)的上市申请亦获CDE受理和优先审评;11月,用于BTK抑制剂治疗后复发/难治性MCL的上市申请获美国FDA受理并授予优先审评资格,成为首个赴美报产的国产BCL2抑制剂。该药预计2026年Q1获批。
2024年ASH年会上公布的I/IB期数据显示,索托克拉片联合泽布替尼用于初治CLL/SLL患者,耐受性优异且缓解深度显著:联合治疗总客观缓解率(ORR)达100%,160mg、320mg剂量组完全缓解(CR)率分别为36%(9/25)、19%(6/32);随治疗时间推进,全剂量组CR率持续攀升,中位CR时间10.1个月(5.4-17.1个月),研究期间两组均无疾病进展。
洛布替尼
药品简介
①药物名称:洛布替尼(Rocbrutinib/LP-168)。
②研发公司:麓鹏制药。
③适应证:套细胞淋巴瘤。
④预计上市时间:2026年Q1。
药物详情
洛布替尼是麓鹏制药自研的全球首创第四代共价-非共价BTK抑制剂,通过双结合机制精准抑制野生型及C481突变型BTK,可克服多代BTK抑制剂因BTK突变导致的耐药问题,对套细胞淋巴瘤(MCL)、CLL/SLL、边缘区淋巴瘤、弥漫大B细胞淋巴瘤(含non-GCB亚型)等B细胞淋巴瘤疗效突出、安全性更优。
2025年5月28日,其用于既往接受过BTK抑制剂治疗的成人套细胞淋巴瘤的上市申请(NDA)获CDE受理并纳入优先审评,预计2026年上半年中国获批,将填补耐药淋巴瘤治疗空白。
玛贝兰妥单抗
药品简介
①药物名称:玛贝兰妥单抗。
②研发公司:GSK。
③适应证:多发性骨髓瘤。
④预计上市时间:2026年Q1。
药物详情
玛贝兰妥单抗(belantamab mafodotin,Blenrep)是GSK研发的全球首款BCMAADC,由人源化抗BCMA单抗、不可切割连接子及微管抑制剂澳瑞他汀F构成,通过靶向+细胞毒双重机制发挥作用。
2024年12月,联合硼替佐米+地塞米松用于既往至少一线治疗的复发/难治性多发性骨髓瘤(R/RMM)的上市申请获中国CDE受理并纳入优先审评;2025年10月重新获FDA批准,同期欧盟获批两项联合适应症,中国预计2026年Q1获批。
2024 ASH大会公布的DREAMM-7试验(中位随访39.4个月)显示:玛贝兰妥单抗联合方案(BVd,n=243)对比达雷妥尤单抗联合方案(DVd,n=251)生存获益显著:死亡风险降低42%(HR=0.58,95%CI:0.43-0.79,p=0.00023);两组中位OS均未达到,BVd组预计mOS为84个月 vs DVd组51个月;3年总生存率74% vs 60%(详见下图),获益最早于治疗4个月时显现并持续存在。其Ⅲ期试验还显示死亡风险降低51%,中位PFS达31.3个月。

▲图源“GSK”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
上文所提及的新药/新技术,不过是众多研发热潮中的冰山一角,实际上还有众多在研的抗癌新药/新技术正在如火如荼地进行中,为广大癌症患者带来了新的希望和更有效的治疗选择。我们也期待这些新药能够顺利通过评审,尽快应用于临床实践,让更多的癌症患者有药可医!
好消息是,当前有多款在研药物已经陆续开启临床试验阶段,这也意味着中国患者将有获得最新抗癌药物免费治疗的机会。与此同时,“方舟援助计划”也可为患者提供已上市/未上市抗癌新药免费治疗的机会。对现有治疗方案不满意或耐药的患者,可将治疗经历、近期病理及影像学检查报告等资料,提交至医学部,进行初步评估或了解详细的入排标准。
参考资料
[1]Girard N,et al. Phase I/II SOHO-01 study of BAY 2927088 in patients with previously treated HER2-mutant NSCLC: Safety and efficacy results from 2 expansion cohorts[C]//Journal of Thoracic Oncology. STE 800, 230 PARK AVE, NEW YORK, NY 10169 USA: ELSEVIER SCIENCE INC, 2025, 20(3): S5-S6.https://www.jto.org/article/S1556-0864(25)00198-4/fulltext
[2]Ahn M J,et al.Tarlatamab for patients with previously treated small-cell lung cancer[J]. New England Journal of Medicine, 2023, 389(22): 2063-2075.
https://www.nejm.org/doi/full/10.1056/NEJMoa2307980
[3]Xu J,et al.KN026 (anti-HER2 bispecific antibody) in patients with previously treated, advanced HER2-expressing gastric or gastroesophageal junction cancer[J]. European Journal of Cancer, 2023, 178: 1-12.
http://ejcancer.com/article/S0959-8049(22)00796-1/fulltext
[4]Qi C,et al.Claudin-18 isoform 2-specific CAR T-cell therapy (satri-cel) versus treatment of physician's choice for previously treated advanced gastric or gastro-oesophageal junction cancer (CT041-ST-01): a randomised, open-label, phase 2 trial[J]. The Lancet, 2025.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(25)00860-8/fulltext
[5]Xu J,et al.A phase 2 study of HMPL-453, a selective FGFR tyrosine kinase inhibitor (TKI), in patients with previously treated advanced cholangiocarcinoma containing FGFR2 fusions[J]. 2023.
https://ascopubs.org/doi/10.1200/JCO.2023.41.16_suppl.e16118
[6]Javle M,et al.Tinengotinib for adults with advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 trial[J]. The Lancet Gastroenterology & Hepatology, 2025.
https://www.thelancet.com/journals/langas/article/PIIS2468-1253(25)00230-4/abstract
[7]Vergote I,et al.Tisotumab vedotin as second-or third-line therapy for recurrent cervical cancer[J]. New England Journal of Medicine, 2024, 391(1): 44-55.
https://www.nejm.org/doi/full/10.1056/NEJMoa2313811
[8]Zhou H,et al.LBA35 Iza-Bren (BL-B01D1), an EGFR× HER3 bispecific antibody-drug conjugate, versus physician's choice of chemotherapy in heavily pretreated recurrent/metastatic nasopharyngeal carcinoma: A randomized, open-label, multicenter, phase III, pivotal study (BL-B01D1-303)[J]. Annals of Oncology, 2025, 36: S1694.
https://www.annalsofoncology.org/article/S0923-7534(25)04816-1/fulltext
[9]https://ascopubs.org/doi/10.1200/JCO.2024.42.16_suppl.3101
[10]https://ecancer.org/en/news/25788-ash-2024-belantamab-mafodotin-shows-significant-os-benefit-reducing-risk-of-death-by-42-in-multiple-myeloma-at-or-after-first-relapse












