全球首个!Breyanzi CAR-T新适应症获FDA批准,总缓解率超84%
小编 2025-12-08
2025年12月4日FDA批准Breyanzi(liso-cel、Lisocabtagene maraleucel)用于复发性或难治性边缘区淋巴瘤
2025年12月4日,利基迈仑赛(liso-cel,Breyanzi®)CAR-T细胞疗法,获得美国食品药品监督管理局(FDA)批准,用于至少接受过两线系统治疗的复发性或难治性边缘区淋巴瘤(MZL)成年患者的治疗。
更具里程碑意义的是,此次批准让Breyanzi成为首个且目前唯一针对该适应症的获批CAR-T细胞疗法,为经多线治疗后病情仍进展的MZL患者点亮了全新治疗希望!不仅填补了MZL治疗领域的空白,更打破了晚期患者“无药可医”的困局,让绝境中的患者迎来重生契机!

▲截图源自“FDA”
Breyanzi CAR-T:FDA认证的抗癌"全能手",横扫白血病及多种淋巴瘤
利基迈仑赛(通用名:Lisocabtagenemaraleucel,简称liso-cel,商品名:Breyanzi)是由百时美施贵宝研发的一款自体、靶向CD19的4-1BB CAR-T细胞疗法。2024年,该疗法在短短三个月内三次斩获美国FDA批准,成为目前覆盖B细胞恶性肿瘤适应症最广泛的CAR-T疗法之一,此前曾获批用于4种不同亚型的非霍奇金淋巴瘤治疗!具体获批适应证如下:
①2024年3月15日(加速批准):用于既往接受过包括BTK抑制剂、BCL-2抑制剂在内的至少2种治疗的成人复发或难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)。
②2024年5月15日(加速批准):用于既往接受过至少两种治疗的复发或难治性滤泡性淋巴瘤(FL)。
③2024年5月31日(正式批准):用于既往接受过包括1种BTK抑制剂在内的至少两种治疗的复发或难治性套细胞淋巴瘤(MCL)成年患者。
而就在2025年12月4日,该药新适应症再次获批,用于至少接受过两线系统治疗的复发性或难治性边缘区淋巴瘤(MZL)的治疗。
Breyanzi创双癌种高缓解奇迹!边缘区淋巴瘤ORR高达84.4%,三线滤泡性淋巴瘤CR率94%
利基迈仑赛(liso-cel,Breyanzi)获FDA批准用于复发性或难治性边缘区淋巴瘤(MZL)的治疗,主要基于TRANSCEND FL II期试验(NCT04245839)中MZL队列的的振奋数据支持!
边缘区淋巴瘤(MZL)
该队列纳入了至少接受过两线系统治疗、或造血干细胞移植(HSCT)后复发的复发/难治性MZL成年患者,且患者ECOG体能状态评分≤1分。治疗流程为:患者先接受淋巴清除化疗(氟达拉滨+环磷酰胺),之后接受单剂量利基迈仑赛输注。
结果显示:在符合意向治疗原则的人群中,患者的总缓解率(ORR)达84.4%(95%CI,74.4%-91.7%),完全缓解率(CR)为55.8%(95%CI:44.1%-67.2%),中位缓解持续时间(DOR)尚未达到(NR;95%CI:25.59-NR),疗效显著且持久。

▲截图源自“Bristol”
滤泡性淋巴瘤(FL)
值得一提的是,同一试验(NCT04245839)的滤泡性淋巴瘤(FL)队列数据,此前已在《Nature Medicine》期刊中公布,该研究也是首个报告CAR-T疗法在二线复发/难治性滤泡性淋巴瘤(R/R FL)患者中疗效的研究。结果同样振奋人心:
1、在三线及以上治疗的FL患者(n=101)中,客观缓解率(ORR)高达97%(95%CI:91.6%-99.4%),完全缓解(CR)率达94%(95%CI:87.5%-97.8%)。
2、在二线FL患者(n=23)中,ORR为96%(95%CI:78.1%-99.9%),且所有有效患者均达到CR。
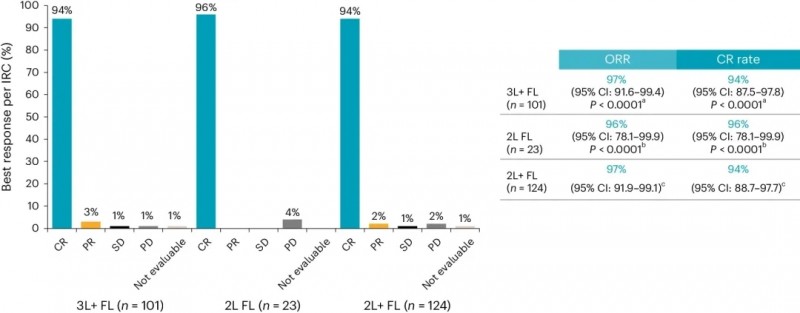
▲图源“Nat Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,利基迈仑赛在至少接受过两线治疗的复发性或难治性边缘区淋巴瘤(MZL)患者中,展现出高缓解率与持久缓解效果,同时在复发/难治性滤泡性淋巴瘤(R/R FL)患者[包括伴有术后24个月内复发(POD 24)等高危特征的二线患者]中,也表现出优异的疗效与安全性。这些数据充分支持利基迈仑赛成为R/R MZL及R/R FL(含二线患者)的重要治疗选择,为多线治疗失败的淋巴瘤患者带来了全新的生存希望!
百万疗法免费招募!中国成功研发多款CAR-T疗法,国内多家中心启动招募
曾经,CAR-T这项先进的治疗技术一直掌握在医疗水平发达的国家,很多病友在苦苦等待中遗憾离开。值得中国病友们振奋的是,“天价”疗法不再遥不可及,中国已成功研发出多款针对多款血液肿瘤及实体瘤的CAR-T疗法,并在国内多家知名癌症中心启动临床,很多晚期患者已通过医学部,成功入组接受治疗!
Part.01、在研癌种及靶点
目前有多款CAR-T临床实验正在火热招募中,主要针对以下靶点及肿瘤类型:
1)Claudin18.2:用于治疗胰腺癌、胃癌等;
2)GPC3:用于肝癌等治疗;
3)GUCY2C:用于结直肠癌的治疗;
4)PSMA:用于治疗前列腺癌等;
5)GPEGFRvII:用于治疗神经胶质瘤、头颈部肿瘤等;
6)CEA:用于治疗肺癌、胰腺癌、胃癌、乳腺癌、结肠癌等;
7)间皮素(mesothelin):用于治疗间皮瘤、胰腺癌、肺癌、卵巢癌等;
8)MUC-1:用于治疗胃癌、肝癌、肺癌、胰腺癌、结肠癌等;
9)B7-H3:用于治疗髓母细胞瘤、肾母细胞瘤、尤文肉瘤、神经母细胞瘤、横纹肌肉瘤、特别难以治疗的脑干肿瘤(DIPG)等。
10)BCMA:用于多发性骨髓瘤等治疗;
11)CD19:用于治疗白血病、淋巴瘤、B细胞急性淋巴细胞白血病等;
12)CD20:用于治疗淋巴瘤、弥漫大B细胞淋巴瘤、B细胞非霍奇金淋巴瘤等。
Part.02、部分入组条件
1)自愿参加本研究并能够签署知情同意书;
2)筛选时年龄18〜70岁;
3)至少有1处可测量靶病灶(根据RECISTvl.l定义);
4)入选和治疗前世界卫生组织(WHO)/ECOG体能状态(PS)评 分为0或1分;
5)经超声心动图左室射血分数(LVEF)>45%;
6)肺部无活动性感染。
Part.03、如何申请
做过基因检测的患者,可自行查看基因检测报告,一旦发现存在上述突变,可将近期病理报告、基因检测报告等资料汇总后,提交至医学部,初步评估是否有机会参加相关临床试验。一旦审核通过,有机会获得”天价“疗法免费治疗的机会。看不懂检测报告或想要明确相关靶点的患者,也可联系医学部,详细解读报告或了解检测详情。
我们的专家将为您全面分析解读检测报告,预计一个工作日内电话联系推荐用药方案,并匹配适合患者入组的临床试验项目。注:我们作为国内权威的肿瘤患者服务平台,我们承诺对所有受试者的个人信息保密,并保证在整个过程中,遵循国家临床研究相关的法律法规。
小编寄语
CAR-T疗法在治疗血液系统恶性肿瘤方面具有广阔的前景,并有多款产品获批上市,不过其在实体瘤治疗方面仍处于临床实验阶段,但小编相信随着CAR-T代数的更迭、更多明星靶点的出现,以及CAR-T在增殖、细胞因子释放等方面的改进,CAR-T攻克晚期实体瘤将指日可待!
事实上,目前已有众多CAR-T治疗肝癌、胃癌、胰腺癌、脑瘤等实体瘤的临床试验相继开展,而且也有幸运的患者得到完全缓解。目前CAR-T、TCR-T、TIL等多项T细胞疗法的临床实验正在招募各类实体瘤患者,对现有治疗手段不满意或想寻求新技术帮助的患者,将病历资料、近期病理报告等,提交至医学部,进行初步评估。
参考资料
[1]Morschhauser F,et al.Lisocabtagene maraleucel in follicular lymphoma: the phase 2 TRANSCEND FL study.Nat Med.2024 Aug;30(8):2199-2207.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11333271/#Sec15
[2]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-lisocabtagene-maraleucel-relapsed-or-refractory-marginal-zone-lymphoma












