中国首个胃癌二线HER2双抗新药申请获药监局受理!胃癌/乳腺癌疗效惊艳
小编 2025-09-18
2025年9月17日国家药监局受理KN026(安尼妥单抗)联合化疗治疗胃癌或胃食管结合部癌的申请
据“OncLive”2025年9月17日报道,中国国家药品监督管理局已受理KN026(安尼妥单抗注射液)联合化疗的新药申请(NDA),该申请旨在批准此联合疗法用于HER2阳性、局部晚期、复发性或转移性胃癌或胃食管结合部(GEJ)癌患者——这类患者需在接受至少1种先前全身治疗(其中必须包含曲妥珠单抗联合化疗方案)后出现疾病进展。
作为中国首个在胃癌二线治疗中取得积极疗效的HER2双特异性抗体,KN026打破了目前HER2阳性胃癌二线治疗无获批抗HER2疗法的困境,具有里程碑式的重要意义!

▲截图源自“OncLive”
国研KN026双抗攻克HER2耐药:胃癌疾病控制率超80%,中位总生存达13.2个月
KN026(安尼妥单抗)是康宁杰瑞基于其专有Fc异二聚体双特异性平台技术CRIB自主研发的重组人源化抗HER2双特异性抗体。它能同时结合HER2蛋白的两个非重叠表位——分别对应帕妥珠单抗识别的结构域II和曲妥珠单抗识别的结构域IV,从而高效阻断HER2信号通路。相较于曲妥珠单抗与帕妥珠单抗的联合用药,KN026在HER2阳性肿瘤细胞系中展现出更优的肿瘤抑制效果,且对曲妥珠单抗耐药细胞系及对标准双重疗法产生获得性耐药的肿瘤细胞均能发挥抑制作用。
本次KN026联合化疗的新药申请,核心依据是2/3期临床试验KN026-001(NCT05427383)的积极数据。截至2024年3月26日数据截止日,该研究共入组39例无法切除或转移性HER2阳性胃癌/胃食管结合部癌(GC/GEJC)患者,并均接受至少一剂治疗,患者中位年龄59.0岁(范围34-78岁),其中87.2%(34例)观察到HER3+染色。
结果显示:经独立评审委员会(IRC)确认的客观缓解率(ORR)为40.0%(95%CI:23.9-57.9),疾病控制率(DCR)为80.0%(95%CI:63.1-91.6),其中8例达病情稳定(SD),14例达部分缓解(PR)。此外,研究者确认的ORR为45.9%(95%CI:29.5-63.1),DCR为81.1%(95%CI:64.8-92.0),其中17例达PR,13例达SD。
在关键生存指标方面,患者中位缓解持续时间11.7个月(95%CI:5.98-未达到),中位无进展生存期(PFS)为8.6个月(95%CI:3.78-13.11),中位总生存期(OS)为13.2个月(95%CI:10.58-20.53)。
综上,KN026联合化疗对一线治疗后进展的HER2阳性胃癌/胃食管结合部癌患者,展现出良好的抗肿瘤疗效与安全性。

▲截图源自“ESMO”
不止胃癌!国研KN026再破HER2阳性乳腺癌,客观缓解率达76.4%,无进展生存27.7个月
KN026(安尼妥单抗)的治疗潜力不止于HER2阳性胃癌,在HER2阳性乳腺癌领域同样展现出显著价值。已知15%-20%的乳腺癌患者存在人类表皮生长因子受体2(HER2)过度表达,这类患者被定义为HER2阳性,其肿瘤往往具有更强的侵袭性且复发率较高。此前I期临床试验已证实,对于既往既定靶向疗法无效的HER2阳性转移性乳腺癌患者,KN026具有可接受的安全性和显著的抗癌效果。
而《癌症通讯》杂志报道的II期临床试验数据则更为振奋——该研究共入组57例HER2阳性复发/转移性乳腺癌患者,均接受KN026联合多西他赛治疗,中位随访时间达31.1个月(范围:0.8~41.4个月)。
结果显示:在55例疗效分析集中,客观缓解率(ORR)达76.4%(95%CI:63.0%-86.8%),临床获益率(CBR)达85.5%(95%CI:73.3%-93.5%);中位缓解持续时间(DOR)未达到(95%CI:20.7个月-未达到),在42例有反应的患者中,12、24和30个月的DOR率分别为85.2%、59.3%、51.6%(详见下图A)。在57例安全性分析集中,中位无进展生存期(PFS)为27.7个月(95%CI:18.0个月-未达到),6、12、24和30个月的PFS率分别为87.4%、76.3%、54.2%、45.2%(详见下图B);中位总生存期(OS)未达到,6、12、24和30个月的OS率分别高达98.2%、93.0%、84.1%、78.5%(详见下图C)。
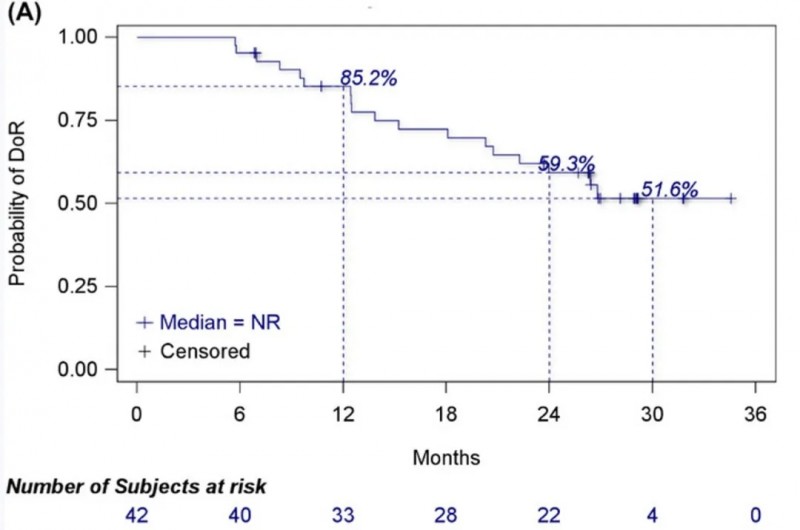
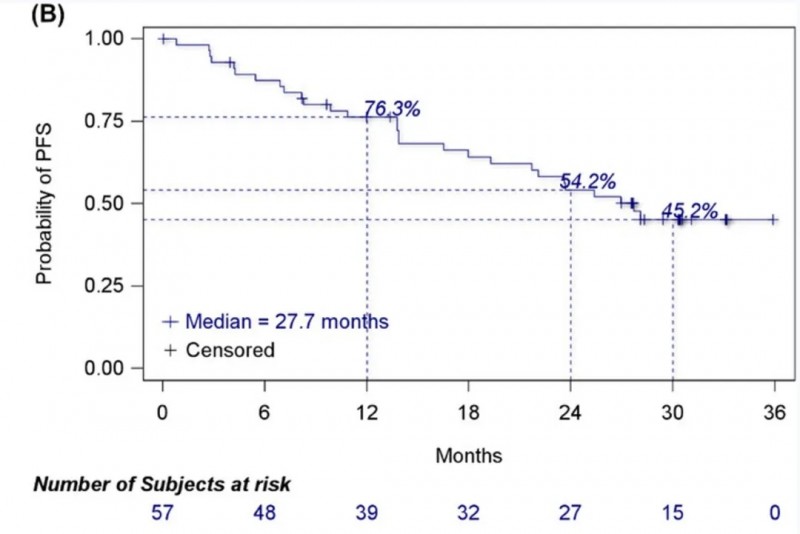
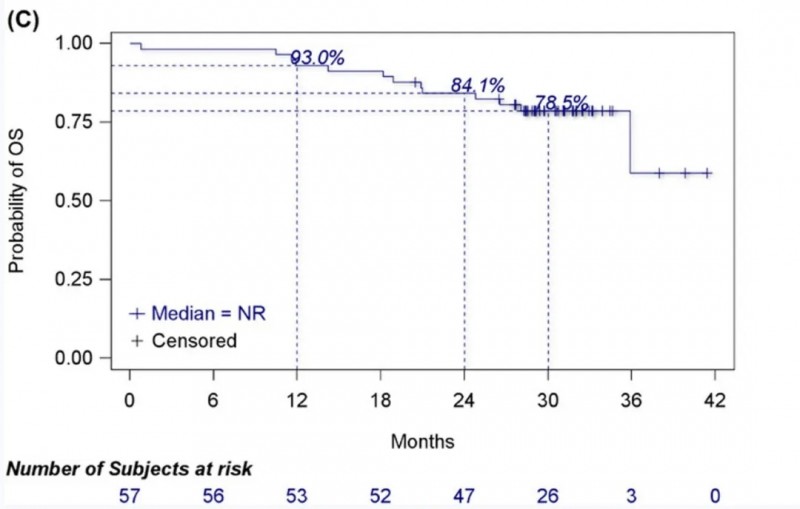
▲图源“Cancer Communications”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,KN026联合多西他赛在HER2阳性复发/转移性乳腺癌的一线治疗中,展现出良好的疗效与可控的安全性。
更多胃癌新药上市在即,国内多中心启动临床
相信看了上面的数据,HER2阳性的胃癌或其他实体瘤患者,一定燃起了新的希望!好消息是,目前我国有多款针对胃癌的新药/新技术正在开展临床研究,现已有大量患者通过抗癌新药招募中心,成功入组接受抗癌新药的治疗!
M108单抗
药品简介
①药品名称:M108单抗注射液。
②治疗靶点:CLDN18.2、HER2、PD-L1。。
③临床分期:Ⅲ期。
④适合人群:初治CLDN18.2阳性、HER2阴性、PD-L1 CPS<5的胃或胃食管交界部腺癌患者。
药物详情
M108单抗注射液是针对靶点Claudin 18.2癌症肿瘤抗原高表达的ADCC增强型单克隆抗体,通过增强型的ADCC效应充分调动患者集体的免疫细胞来杀伤肿瘤细胞。
招募信息(部分)
1)年龄18-75周岁(含边界),性别不限。
2)经组织学确诊的局部晚期不可切除或转移性胃或胃食管交界处腺癌,未经全身治疗的受试者,或对于既往接受新辅助/辅助化疗的受试者,末次治疗至疾病复发时间>6个月。
3)能提供存档病理组织或新鲜病理组织用于CLDN18.2检测,中心实验室检测肿瘤组织CLDN18.2阳性。
4)肿瘤组织HER-2阴性,且经中心实验室检测PD-L1表达联合阳性分数(CPS)<5。
LM-302
药品简介
①药品名称:LM302注射液。
②治疗靶点:CLDN18.2。
③临床分期:Ⅱ期,Ⅲ期。
④适合人群:CLDN18.2阳性局部晚期或转移性胃/胃食管交界处腺癌。
药物详情
LM-302是由礼新医药自主研发的具有首创新药(First-in-class)潜力的CLDN18.2抗体偶联药物(ADC)。其能特异靶向CLDN18.2阳性的肿瘤细胞并通过内吞进入肿瘤细胞,释放小分子毒素,从而起到抗肿瘤作用。
招募信息(部分)
1)男女不限,签署ICF 时年龄在18-80岁(含临界值)。
2)东部肿瘤合作组织(ECOG)标准,体能状态为0-1分。
3)经组织学/细胞学确诊的局部晚期或转移性胃/胃食管交界处腺癌,既往至少接受二线系统性治疗。
申请流程
想申请抗癌新药临床试验的患者,需将近期病理报告、基因检测报告等资料汇总后,提交至医学部,进行初步评估。
我们的专家将为您全面分析解读检测报告,预计一个工作日内电话联系推荐用药方案,并匹配适合患者入组的临床试验项目。注:作为国内权威的肿瘤患者服务平台,我们承诺对所有受试者的个人信息保密,并保证在整个过程中,遵循国家临床研究相关的法律法规。
小编寄语
近年来,胃癌及乳腺癌的治疗已经取得了长足的进展,逆转了晚期患者的生存期,除了上面整理的内容,还有更多的新药正在研发中。如果您对现有治疗方案不满意,或想了解胃癌/乳腺癌更多抗癌新药/新技术的更多讯息,可将治疗经历、近期病理检查报告、出院小结等,提交至医学部,进行初步评估。
参考资料
[1]https://www.onclive.com/view/kn026-nda-in-pretreated-her2-gastric-or-gej-cancer-accepted-by-nmpa-for-review
[2]Ma J,et al. Efficacy and safety of KN026 and docetaxel for HER2‐positive breast cancer: a phase II clinical trial[J]. Cancer Communications, 2025, 45(4): 476-485.
https://onlinelibrary.wiley.com/doi/10.1002/cac2.12662












