肺癌患者有救了!中国领衔十大抗癌新药重磅现身2025 WCLC,生存期延长,脑转移可用
小编 2025-08-25
中国领衔十大肺癌抗癌药新药重磅现身2025 WCLC,生存期延长,脑转移可用,肺癌患者有救了
2025年IASLC世界肺癌大会(WCLC)将于9月6日至9日在西班牙巴塞罗那的巴塞罗那格兰维亚会展中心举行。作为全球最具影响力的肺癌领域会议之一,本次大会将集中发布多项肺癌领域重磅研究进展。
2025年7月22日(当地时间),WCLC官网已率先公布部分入选研究,内容覆盖肺癌筛查、诊断、治疗、预后等核心方向,同时明确大会主要报告形式:微型口头报告(Mini Oral,简称MA)设11个模块,覆盖早期、晚期肺癌及小细胞肺癌等阶段;口头报告(Oral Abstract,简称OA)设18个模块,除覆盖上述疾病阶段外,还细分为EGFR及罕见突变、ADC新药、特殊人群免疫治疗等方向;另有教育专场(Education Session)。
以下,医学部将梳理本次会议中值得重点关注的抗癌新药,为癌友们提供参考、增强战胜癌症的信心。我们坚信,每一项研究突破都在拉近“癌症可治”的梦想,每一份坚持都将铸就生命的奇迹!
2025 WCLC大会捷报:十大抗癌新药重磅登场,强势革新小细胞/非小细胞肺癌治疗版图
小细胞肺癌新药
1、SHR-4849(IDE849)
会议标题及摘要号:
OA06.01A First-In-Human Phase 1 Study of SHR-4849 (IDE849), a DLL3-Directed Antibody-Drug Conjugate, in Relapsed SCLC(针对复发性小细胞肺癌 (SCLC) 的 DLL3 靶向抗体-药物偶联物 SHR-4849 (IDE849) 的首次人体 I 期研究)

药物简介
SHR-4849是恒瑞医药自主研发的靶向Delta样配体3(DLL3)的抗体药物偶联物(ADC),其有效载荷为拓扑异构酶抑制剂(TOPOi)。凭借独特优势与出色的早期临床数据,该药物正为肺癌患者带来新的治疗希望。
Delta样配体3(DLL3)在多种实体瘤中呈高表达态势,例如在约85%的小细胞肺癌、20%-40%的神经内分泌肿瘤中均有高表达,而在正常组织中表达有限。这一特性使SHR-4849能够精准靶向肿瘤细胞,具备良好的治疗特异性。
WCLC前沿数据抢先看:
目前,该药物正在中国紧锣密鼓地开展针对晚期实体瘤的临床Ⅰ期试验(NCT06443489),处于剂量爬坡阶段,并且已在多个剂量组观察到了临床应答。
截至2024年12月10日,该药物早期临床数据已初见曙光。在有效剂量下,依据RECIST1.1标准、至少接受过一次基线后肿瘤评估的11例小细胞肺癌可疗效评估患者中,结果显示:8例达到部分缓解(PR),总应答率(ORR)约73%;同时,暂未发生任何因药物导致的终止用药不良事件,安全性可控。
2、QLC5508
会议标题及摘要号:
OA06.02 Safety and Efficacy of QLC5508 in Previously Treated Patients with Small Cell Lung Cancer: Updated Data from a Phase 1 Study(QLC5508 对既往接受过治疗的小细胞肺癌患者的安全性和有效性:1 期研究的最新数据)

药物简介
QLC5508(MHB088C)是一款新型 B7-H3 靶向抗体药物偶联物(ADC),具有高细胞结合活性与内化率,其搭载的有效载荷 SuperTopoiTM 效力为 Dxd 的 5 至 10 倍。
因B7-H3 在小细胞肺癌等多种实体瘤中高表达、在正常组织中低表达,QLC5508 可精准识别并结合肿瘤细胞表面的 B7-H3,经内吞作用进入细胞后释放强效拓扑异构酶抑制剂,通过阻断 DNA 复制诱导肿瘤细胞凋亡;同时借助旁观者效应,让释放的毒素作用于肿瘤微环境中其他肿瘤细胞,扩大杀伤范围以实现高效抗肿瘤活性。凭借独特作用机制与出色临床数据,QLC5508 为小细胞肺癌治疗提供了新方向与新选择。
WCLC前沿数据抢先看:
在2025 WCLC大会上,将更新QLC5508治疗广泛期小细胞肺癌(ES-SCLC)的研究数据,以最新突破性摘要(LBA)入选大会口头报告,我国同济大学附属东方医院专家团队将在“小细胞肺癌ADC新药”专场汇报。
多中心Ⅰ期研究含剂量递增与扩展阶段,纳入既往铂类化疗±PD-1/PD-L1治疗失败、既往治疗≤3线或无法耐受标准治疗的ES-SCLC患者,采用三个剂量组(1.6/2.0/2.4mg/kg),静脉输注QLC5508。
结果显示:三组确认客观缓解率(ORR)分别为21.4%、42.2%、43.3%,疾病控制率(DCR)分别为89.3%、84.4%、100%,中位无进展生存期(mPFS)分别为5.55个月、5.95个月、5.52个月,中位总生存期(mOS)分别为11.50个月、11.73个月、11.50个月。相较于拓扑替康等传统二线治疗(中位OS约6-8个月),QLC5508显著延长患者生存期,为多线治疗失败患者带来新希望。
非小细胞肺癌新药
3、德达博妥单抗
会议标题及摘要号:
OA10.01 Intracranial Efficacy of Datopotamab Deruxtecan (Dato-DXd) in Patients With Advanced/Metastatic NSCLC in TROPION-Lung01(TROPION-Lung01 研究中 Datopotamab Deruxtecan (Dato-DXd) 对晚期/转移性 NSCLC 患者的颅内疗效)

药物简介
德达博妥单抗(Dato-DXd,Datopotamab Deruxtecan)是第一三共和阿斯利康联合开发的一款靶向Trop-2的DXd抗体偶联药物(ADC),2024年3月16日该药的上市申请获得中国国家药品监督管理局药品审评中心(CDE)受理,拟用于成人既往接受过系统治疗的HR阳性、HER2阴性的不可切除或转移性乳腺癌的治疗。
WCLC前沿数据抢先看:
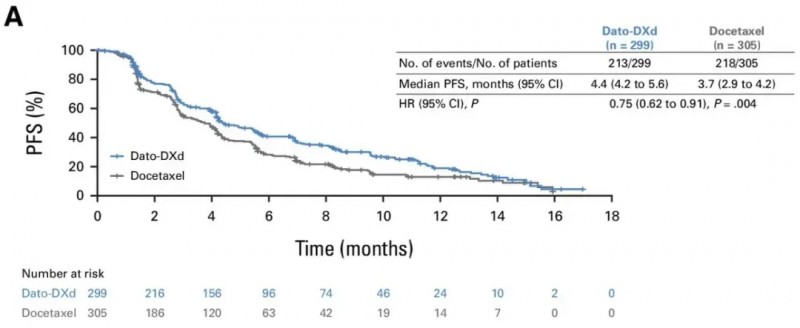
在Ⅲ期TROPION-Lung01 研究中,针对基线存在脑转移的晚期 / 转移性非小细胞肺癌(NSCLC)患者,Dato-DXd 治疗表现出色。
结果显示:中位总生存期(OS)分别为12.9个月(Dato-DXd组,范围11.0~13.9) vs 11.8 个月(多西他赛组,范围10.1~12.8)。中位无进展生存期(PFS)分别为4.4个月(Dato-DXd组,范围4.2~5.6)vs 3.7个月(多西他赛组,范围2.9~4.2)。为这类预后较差的患者群体提供了新的治疗选择,有望改善他们的生存质量与生存时间。
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
4、贝伐单抗(Bevacizumab)
会议标题及摘要号:
OA10.02 Bevacizumab Plus Chemotherapy Versus Chemotherapy in Untreated Non-Squamous NSCLC With Brain Metastases: A Randomized, Phase 3 Study(贝伐单抗联合化疗对比化疗治疗未经治疗的非鳞状非小细胞肺癌脑转移:一项随机、3 期研究)

药物简介
贝伐单抗(Bevacizumab)是一种针对VEGF的单克隆抗体,是第一个被批准用于上皮性卵巢癌的靶向治疗药物,是全球首个获批上市的抗血管内皮生长因子(VEGF)单克隆抗体,通过阻断肿瘤血管生成发挥抗癌作用,至今仍是多种实体瘤治疗的重要选择,在肺癌领域应用尤为广泛。
WCLC前沿数据抢先看:
2025年世界肺癌大会(WCLC)公布了多项贝伐单抗相关研究成果,重点聚焦非小细胞肺癌(NSCLC)脑转移及一线治疗联合方案领域。其中就包括中山大学肿瘤防治中心团队,将在大会上公布贝伐珠单抗联合化疗一线治疗非鳞状NSCLC脑转移的Ⅲ期随机研究数据。
既往研究数据显示:贝伐珠单抗联合化疗组的中位颅内无进展生存期(iPFS)达11.07个月,显著优于单纯化疗组的5.73个月(HR=0.439,P<0.001);联合治疗组的全身无进展生存期(PFS)也显著延长,为8.77个月,单纯化疗组为5.23个月(HR=0.540,P<0.001)。此外,联合治疗组的颅内客观缓解率(iORR)、全身客观缓解率(ORR)及脑水肿缓解率均更优,且未发生≥3级颅内出血事件,多数不良事件可控。
5、Iza-Bren(BL-B01D1)
会议标题及摘要号:
OA10.03 Phase I/II Study of Iza-Bren (BL-B01D1) as Monotherapy in Patients With Locally Advanced or Metastatic EGFR Mutated NSCLC[Iza-Bren (BL-B01D1) 单药治疗局部晚期或转移性 EGFR 突变 NSCLC 患者的 I/II 期研究]

药物简介
BL-B01D1是中国百利药业自主开发的全球首个靶向EGFR和HER3双靶点的ADC,其中HER3更是已经被验证有用于治疗EGFR抑制剂耐药患者的潜力。
WCLC前沿数据抢先看:
在2025 年世界肺癌大会(WCLC)上,肺癌治疗领域的创新药物 BL-B01D1 成为焦点之一,其公布的最新研究成果为肺癌患者带来了新的希望与治疗选择。
此前在2023年ASCO大会上,就曾公布了BL-B01D1治疗实体瘤的I期临床研究数据,其中38例经治EGFR突变非小细胞肺癌患者,全部接受过靶向治疗,其中89%为3代靶向药(奥希替尼、阿美替尼等),这些经治的EGFR突变患者客观缓解率(ORR)高达63.2%,疾病控制率(DCR)高达89.5%。
6、帕博利珠单抗(Pembrolizumab)
会议标题及摘要号:
MA04.04 Perioperative Pembrolizumab in Non-Small Cell Cancer (NSCLC): 4-Year Outcomes by Nodal Status in the KEYNOTE-671 Study[帕博利珠单抗治疗非小细胞癌 (NSCLC) 的围手术期疗效:KEYNOTE-671 研究中按淋巴结状态划分的 4 年疗效结果]

药物简介
帕博利珠单抗(派姆单抗,pembrolizumab,商品名 Keytruda)是默沙东(MSD)研发的重磅抗 PD-1 抑制剂,也是中国首个获批上市的 PD-1 抑制剂,通过增强人体免疫系统功能,助力其发现并对抗肿瘤细胞。
其针对非小细胞肺癌(NSCLC)的一线治疗适应证包括:1)单药一线治疗 PD-L1 阳性(≥1%)、EGFR/ALK 阴性的局部晚期或转移性 NSCLC;2)联合紫杉醇及卡铂,一线治疗转移性鳞状 NSCLC;3)联合铂类化疗与培美曲塞,一线治疗 EGFR/ALK 阴性的转移性非鳞状 NSCLC。
WCLC前沿数据抢先看:
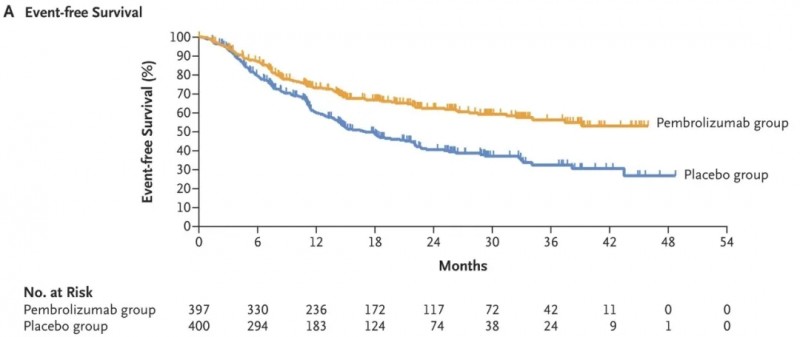
本次WCLC大会将更新帕博利珠单抗(Pembrolizumab)治疗非小细胞肺癌(NSCLC)围手术期的KEYNOTE-671研究(NCT03425643)4年结果。
该研究此前公布的数据显示:帕博利珠单抗组24个月总生存(OS)率估计为80.9%,安慰剂组为77.6%(P=0.02,未达显著性标准);帕博利珠单抗组主要病理缓解率为30.2%,显著高于安慰剂组的11.0%。无事件生存期方面,帕博利珠单抗组中位无事件生存期未达到(95%CI:34.1个月-未达到),安慰剂组为17.0个月(95%CI:14.3-22.0个月),帕博利珠单抗组疾病进展、复发或死亡风险显著降低(HR=0.58;95%CI:0.46-0.72;P<0.001)(详见下图)。
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
7、瑞普替尼(Repotrectinib)
会议标题及摘要号:
MA02.03 Repotrectinib in Patients With ROS1 Fusion-Positive (ROS1+) NSCLC: Long-Term Follow-Up From the Phase 1/2 TRIDENT-1 Trial [Repotrectinib 治疗 ROS1 融合阳性 (ROS1+) NSCLC 患者:1/2 期 TRIDENT-1 试验的长期随访结果]

药物简介
瑞普替尼(Repotrectinib,代号TPX-0005)是美国研发的第二代ALK/ROS1/TRK抑制剂,由再鼎医药研发。这款针对ROS1阳性晚期NSCLC的全球重磅新药一直被誉为”同类最佳药物“,同时也是首款获批上市的第二代NTRK/ROS1抑制剂!
WCLC前沿数据抢先看:
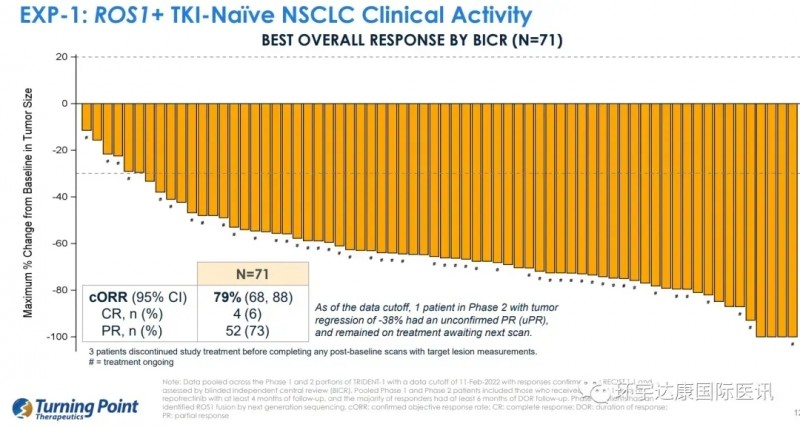
2025年WCLC大会将公布瑞普替尼治疗ROS1融合阳性(ROS1+)非小细胞肺癌(NSCLC)患者的长期随访数据。
该药物此前TRIDENT-1首次人体试验数据显示:中位随访24.0个月时,71例未接受过靶向治疗(初治)的患者中,经盲法独立中央审查(BICR)评估的确认客观缓解率(cORR)为79%,中位缓解持续时间(DOR)34.1个月,中位无进展生存期(PFS)35.7个月(接近3年)。这表明近80%的晚期患者接受治疗后病灶缩小超30%(部分患者靶病灶完全消失),且疾病无进展的平均时间近3年。
8、舒沃替尼(Sunvozertinib)
会议标题及摘要号:
MA08.01A Multinational Phase 2 Randomized Pivotal Study of Sunvozertinib in Pretreated NSCLC With EGFR Exon 20 Insertion Mutations(一项针对 Sunvozertinib 治疗 EGFR 外显子 20 插入突变的经治非小细胞肺癌的多国 2 期随机关键研究)

药物简介
舒沃替尼片(Sunvozertinib,DZD9008,商品名舒沃哲®)是迪哲医药自主研发的口服、不可逆、高选择性EGFR酪氨酸激酶抑制剂,可针对多种EGFR突变亚型。
该药于2023年8月22日在中国获批首个适应症,用于既往经含铂化疗进展/不耐受、且经检测确认存在EGFR exon20ins的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者,也是中国上市的首款国研EGFR靶向药。
2025年7月,再获美国FDA批准,用于经含铂化疗进展、确认存在 EGFR exon20ins的局部晚期或转移性NSCLC成人患者,成为全球首款在美国获批该适应证的中国创新药。
WCLC前沿数据抢先看:
本次WCLC大会将更新舒沃替尼(Sunvozertinib)治疗经治EGFR20号外显子插入突变非小细胞肺癌(NSCLC)的多国II期随机关键研究数据。
该药物此前全球1/2期WU-KONG1研究(NCT03974022)与中国2期WU-KONG15研究(NCT05559645)的汇总分析显示:所有患者(100%)目标病变均实现肿瘤缩小,两组剂量组确认客观缓解率(ORR)均达78.6%;在多种EGFR20号外显子插入突变亚型及基线脑转移患者(6/9,66.7%)中,均观察到肿瘤缓解。
9、埃万妥单抗(Amivantamab)
会议标题及摘要号:
MA08.04 Phase 2 Interim Results of Zipalertinib in Patients With NSCLC Harboring Uncommon Non-Exon 20 Insertion EGFR Mutations(Zipalertinib 治疗携带罕见非外显子 20 插入 EGFR 突变的 NSCLC 患者的 2 期中期结果)

药物简介
埃万妥单抗注射液是一种新型EGFR-MET双特异性抗体,可靶向作用于激活及耐药的EGFR和MET突变与扩增,也是全球首款获批上市的EGFR/MET双特异性抗体。
2025年该药在中国两度获批:2月11日首次获批,单药用于EGFR20号外显子插入突变(EGFR20ins)的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)一线治疗。4月25日再度获批,与卡铂+培美曲塞联合用于EGFR19号外显子缺失(19del)/21号外显子L858R突变、且经EGFR-TKI治疗进展的局部晚期或转移性非鳞状NSCLC成人患者。
WCLC前沿数据抢先看:
2025 WCLC大会将公布“一线皮下注射Amivantamab联合化疗,治疗EGFR exon20ins突变晚期非小细胞肺癌”PALOMA-2研究的结果。
此前公布的III期临床研究MARIPOSA-2(NCT04988295)关键数据,结果显示:埃万妥单抗联合化疗组、埃万妥单抗联合拉泽替尼及化疗组的无进展生存期(PFS)均显著优于单纯化疗组,经盲法独立中心审查,三组中位PFS分别为6.3个月(95%CI:5.6-8.4)、8.3个月(95%CI:6.8-9.1)、4.2个月(95%CI:4.0-4.4),疾病进展或死亡风险分别降低52%和56%。
10、替雷利珠单抗(Tislelizumab)
会议标题及摘要号:
MA04.07 A Phase 2 Multicenter Umbrella Trial Assessing Tislelizumab ± Anti-TIGIT or Anti-LAG-3 mAb ± Chemotherapy in Resectable NSCLC(一项 2 期多中心伞状试验,评估替雷利珠单抗±抗 TIGIT 或抗 LAG-3 mAb±化疗在可切除非小细胞肺癌中的疗效)

药物简介
替雷利珠单抗(Tislelizumab,商品名TEVIMBRA®、百泽安®)是由百济神州研发的一款针对PD-1受体的人源化免疫球蛋白G4单克隆抗体。其独特之处在于,能最大限度减少与巨噬细胞上Fcγ受体的结合,有效打破癌细胞的防御机制,助力免疫系统精准识别并及时杀伤肿瘤细胞。
它是首个在海外获批治疗非小细胞肺癌的中国原研PD-(L)1单抗,同时也是首个获得美国及欧盟双认证的中国原研PD-(L)1单抗!
WCLC前沿数据抢先看:
2025年WCLC大会上,我国研究团队将公布替雷利珠单抗RATIONALE-315研究的最终分析结果,为可切除非小细胞肺癌(NSCLC)治疗带来新曙光。
此前于2024年ESMO大会公布的Ⅲ期数据(NCT04379635)显示:替雷利珠单抗联合新辅助化疗组(TIS组)的病理学完全缓解率(pCR率)达40.7%,显著高于安慰剂组的5.7%(详见下图);主要病理学缓解率(MPR率)为56.2%,同样显著高于安慰剂组的15.0%(详见下图)。
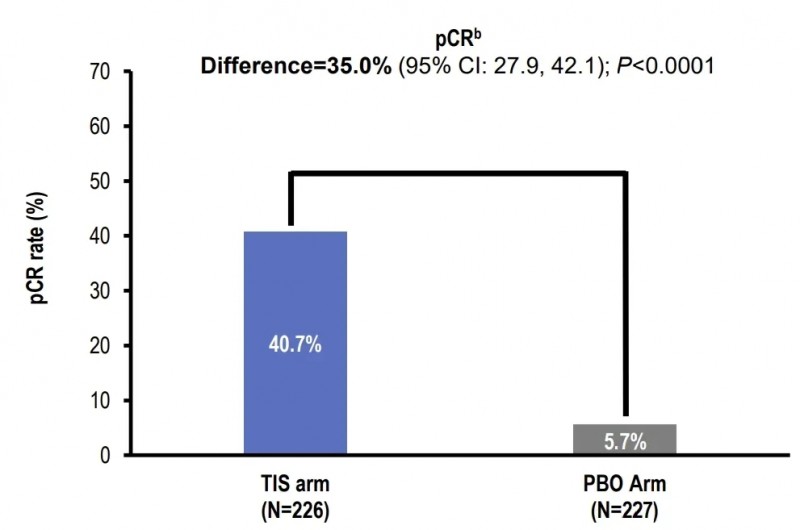
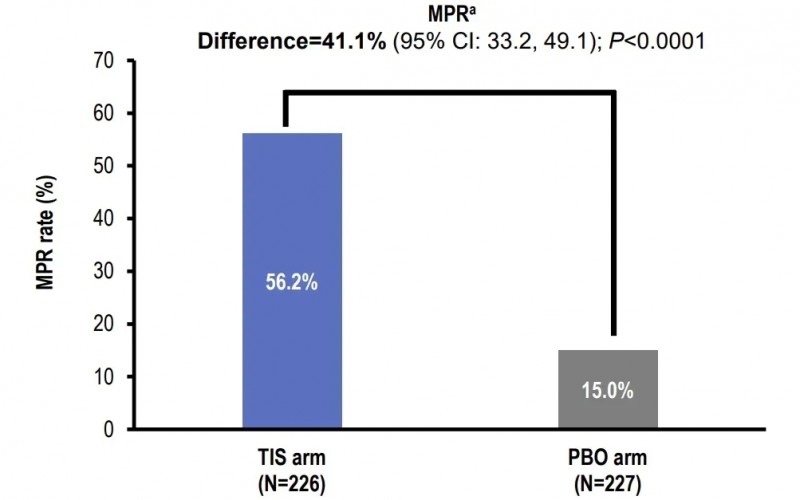
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
在过去十年,肺癌的治疗已经取得了长足的进展,逆转了晚期癌症患者的生存期,除了上面提到的这些药物外,还有更多的抗癌新药正在研发中!小编也期望未来会有更多的抗癌新药获批上市,亦或是纳入医保范畴,让更多的癌症患者有病可医,有药可用!
好消息是,目前有多款抗癌新药、新技术正在中国开展临床试验,同时“方舟援助计划”也可为患者提供上市新药和未上市新药免费治疗的机会。想参加临床试验或寻求抗癌新技术帮助的患者,可联系医学部,了解详细的入排标准,并初步评估病情。
参考资料
[1]Ahn M J,et al.Datopotamab deruxtecan versus docetaxel for previously treated advanced or metastatic non–small cell lung cancer: The randomized, open-label phase III TROPION-Lung01 study[J]. Journal of Clinical Oncology, 2025, 43(3): 260-272.
https://ascopubs.org/doi/10.1200/JCO-24-01544?url_ver=Z39.882003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
[2]Wakelee H,et al.Perioperative pembrolizumab for early-stage non–small-cell lung cancer[J]. New England Journal of Medicine, 2023, 389(6): 491-503.
https://www.nejm.org/doi/full/10.1056/NEJMoa2302983
[3]https://cattendee.abstractsonline.com/meeting/21151/meeting-info












