2025医保目录调整启动!23款抗癌新药有望入围,惠及肺癌、肝癌、胃癌等十七大癌种
小编 2025-07-08
抗癌药医保目录2025新消息,23款抗癌新药有望入围,惠及肺癌、肝癌、胃癌等十七大癌种
2025年上半年将尽,国家医保局近日发布《2025年国家基本医疗保险、生育保险和工伤保险药品目录及商业健康保险创新药品目录调整工作方案》等文件,公开征求意见,标志着本年度医保目录调整正式启动。值得关注的是,今年首次纳入商业健康保险创新药品目录制定,将进一步完善我国多层次医疗保障体系。
据不完全统计,2025年上半年国内至少有111款药物(含新适应症)获批上市。其中,抗肿瘤药物涉及23款,位居榜首;全身用抗感染药物(13款,11.7%)、消化系统及代谢药物(14款)、神经系统药物(13款)紧随其后,其余治疗领域获批药物均不足10款。
随着2025版医保目录调整推进,哪些抗肿瘤药物有望入选?小编特为广大癌友整理了一份“有望进入新版医保目录的抗肿瘤药物清单”,供癌友们参考收藏,以备不时之需。
2025有望进入新版医保目录的抗肿瘤药物全面盘点
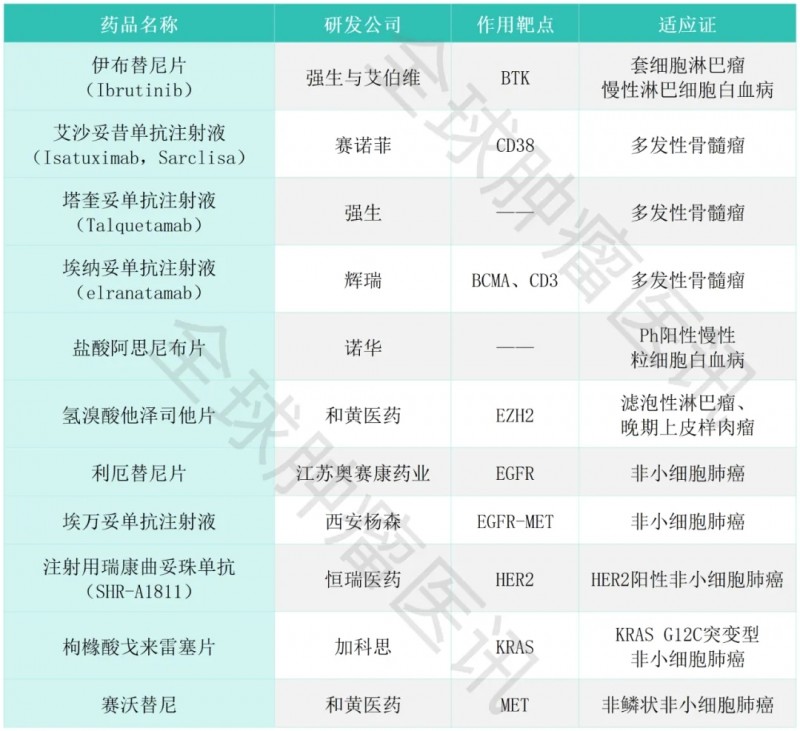
01、伊布替尼片
药品名称:伊布替尼片(Ibrutinib)
研发公司:强生与艾伯维
作用靶点:BTK
适应证:慢性淋巴细胞白血病、套细胞淋巴瘤等
药品详情
伊布替尼是一种高效、选择性的BTK抑制剂,同时也是全球首个获批上市的BTK抑制剂,在血液肿瘤治疗领域应用广泛。
2013年11月,伊布替尼胶囊获美国FDA批准上市,用于复发难治性慢性淋巴细胞白血病和套细胞淋巴瘤的治疗。2017年8月24日,伊布替尼正式获得中国食品药品监督管理总局批准,用于慢性淋巴细胞白血病及套细胞淋巴瘤的治疗。此外,2025 年 1 月 8 日,齐鲁制药(海南)有限公司按注册分类 3 类申报的伊布替尼片获批上市,为国内该剂型首仿。
02、艾沙妥昔单抗注射液
药品名称:艾沙妥昔单抗(Isatuximab,Sarclisa)
研发公司:赛诺菲(Sanofi)
作用靶点:CD38
适应证:多发性骨髓瘤
药品详情
艾沙妥昔单抗(Isatuximab,Sarclisa)是一种抗CD38单克隆抗体,2025年1月9日,艾沙妥昔单抗获中国国家药品监督管理局(NMPA)批准,与泊马度胺和地塞米松联合,用于成人既往接受过至少一线治疗(包括来那度胺和蛋白酶体抑制剂)的多发性骨髓瘤的治疗。此前(2024年9月20日)该药已获得美国FDA批准上市,与硼替佐米、来那度胺和地塞米松联合,用于成人、新诊断、且不适合进行自体干细胞移植(ASCT)的多发性骨髓瘤(NDMM)的治疗。
03、塔奎妥单抗注射液
药品名称:塔奎妥单抗(Talquetamab)
研发公司:强生
适应证:多发性骨髓瘤
药品详情
塔奎妥单抗(Talquetamab)是一种First-in-Class双特异性抗体和人源化单克隆抗体,同时也是一种CD3E调节剂。2025年2月11日,塔奎妥单抗获得中国国家药品监督管理局(NMPA)的上市批准,用于成人复发或难治性多发性骨髓瘤的治疗。此前(2023年8月9日)该药就已获得美国FDA的加速批准,用于成人既往已接受过至少4种治疗(包括免疫调节剂、CD38单克隆抗体、蛋白酶体抑制剂抗)的复发性或难治性多发性骨髓瘤的治疗。
Monumen TAL-1(NCT03399799)临床研究数据显示:在接受405μg和800μg剂量的塔奎妥单抗治疗组中,中位随访时间分别为11.7个月和4.2个月,患者的反应率分别为70%(95%CI:51~85)和64%(95%CI:48~78)(详见下图);两组的中位缓解持续时间则分别为10.2个月和7.8个月。
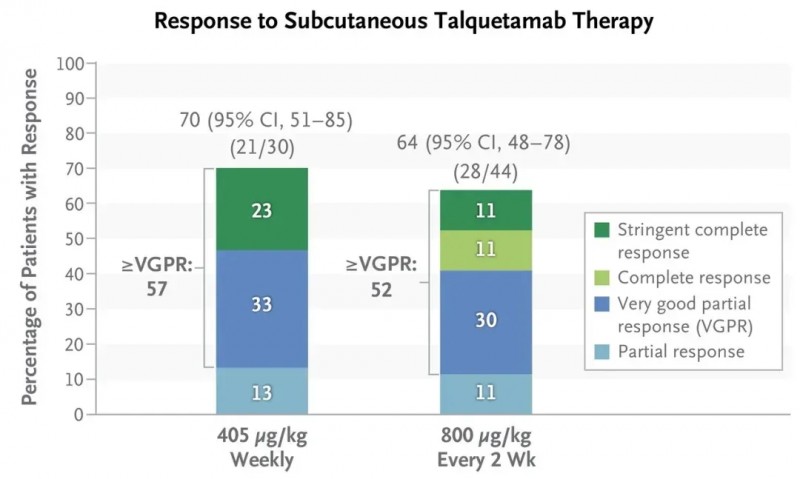
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
04、埃纳妥单抗注射液
药品名称:埃纳妥单抗(elranatamab)
研发公司:辉瑞
作用靶点:BCMA、CD3
适应证:多发性骨髓瘤
药品详情
埃纳妥单抗(Elranatamab,Elrexfio)是一种BCMA和CD3的双特异性抗体,旨在靶向在肿瘤细胞上高表达的BCMA和T细胞表面的CD3。2025年3月10日,该药获国家药品监督管理局(NMPA)附条件批准上市,用于既往接受过至少三线治疗(包括1种免疫调节剂、1种抗CD38单克隆抗体、1种蛋白酶体抑制剂)的复发或难治性多发性骨髓瘤(RRMM)成年患者的治疗。
本次获批主要基于一项MagnetisMM-3的2期临床试验(NCT04649359)数据,结果显示:客观缓解率(ORR)达61.0%(95%CI:51.8-69.6)。其中,35.0%的患者达到完全缓解(CR)或更优状态(≥CR)。此外,15个月时,Kaplan-Meier评估的无进展生存期(PFS)率为50.9%,中位总生存期(OS)率为56.7%。
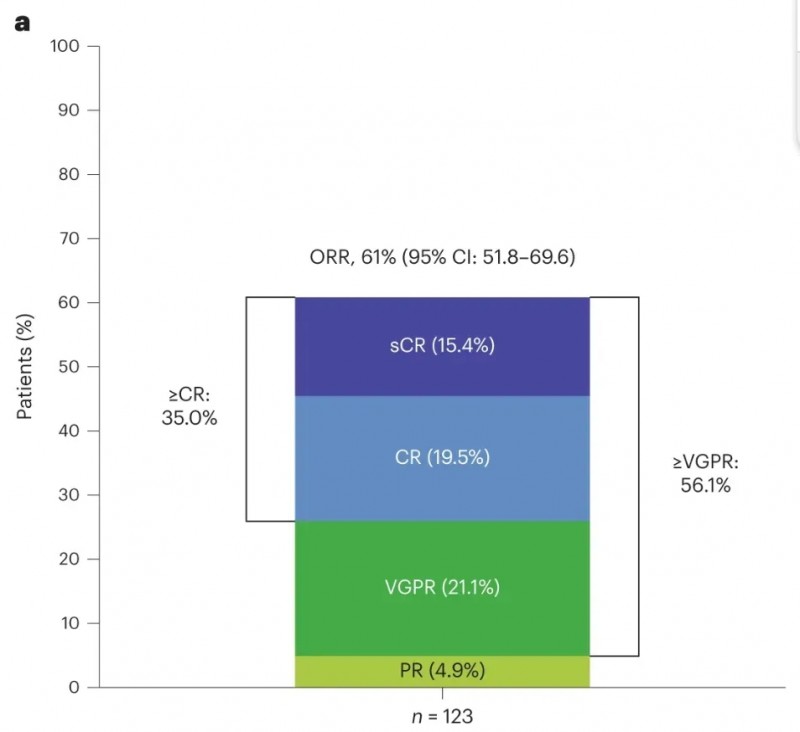
▲图源“Nature medicine”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
05、盐酸阿思尼布片
药品名称:盐酸阿思尼布片(Asciminib,Scemblix®,信倍立®)
研发公司:诺华
适应证:Ph阳性慢性粒细胞白血病
药品详情
阿思尼布(asciminib)是一种针对慢性髓细胞白血病(CML)的靶向治疗药物,2025 年 5 月 14 日,获中国国家药品监督管理局批准,用于成人新诊断的费城染色体阳性的慢性髓细胞白血病(Ph+CML)慢性期(CP)的治疗。此前(2024年10月29日)获FDA批准,用于成人新诊断的费城染色体阳性慢性粒细胞白血病(Ph+CML)慢性期的治疗。
一项ASC4FIRST临床试验(NCT04971226)结果显示:阿思尼布的MMR(主要分子反应)率明显优于标准治疗,48周时的MMR率分别为68%(阿思尼布组) vs 49%[酪氨酸激酶抑制剂(IS-TKI组)]。
06、氢溴酸他泽司他片
药品名称:他泽司他(Tazemetostat,Tazverik)
研发公司:和黄医药
作用靶点:EZH2
适应证:滤泡性淋巴瘤、晚期上皮样肉瘤
药品详情
他泽司他是一款口服的小分子EZH2抑制剂,2025年3月21日,该药获中国国家药品监督管理局(NMPA)批准,用于成人EZH2突变阳性且既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)的治疗。
此前(2020年1月),他泽司他已获得美国FDA的加速批准,用于晚期上皮样肉瘤、复发/难治性滤泡性淋巴瘤的治疗,至此该药也成为了全球首款获批上市的EZH2抑制剂,具有里程碑式的重要意义!
07、利厄替尼片
药品名称:利厄替尼片
研发公司:江苏奥赛康药业
作用靶点:EGFR
适应证:非小细胞肺癌
药品详情
利厄替尼是具有全新分子结构的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),2025年4月25日,该药的新适应症上市申请在中国获批,适用于具有EGFR外显子19缺失(19DEL)或外显子21置换突变(L858R)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
08、埃万妥单抗注射液
药品名称:埃万妥单抗注射液(锐珂®,Rybrevant,amivantamab-vmjw,代号为JNJ6372)
研发公司:西安杨森
作用靶点:EGFR-MET
适应证:非小细胞肺癌
药品详情
埃万妥单抗注射液是一种新型EGFR-MET双特异性抗体,可靶向激活及耐药的EGFR和MET突变与扩增,也是全球首款获批上市的EGFR/MET双特异性抗体。
该药的全球获批始于2021年5月,获美国FDA加速批准,成为全球首个针对该靶点的靶向疗法。2025年,在中国两度获批:2月11日首次获批,单药用于EGFR20号外显子插入突变(EGFR20ins)的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)一线治疗;4月25日再度获批,联合卡铂+培美曲塞,用于EGFR19号外显子缺失(19del)/21号外显子L858R突变且经EGFR-TKI治疗进展的局部晚期或转移性非鳞状NSCLC成人患者。
该药在中国获批主要基于一项MARIPOSA-2III期临床研究(NCT04988295))的关键数据!埃万妥单抗联合化疗组、埃万妥单抗联合拉泽替尼及化疗组的无进展生存期(PFS)均显著优于单纯化疗组,疾病进展或死亡风险分别降低52%和56%;经盲法独立中心审查,三组中位PFS分别为6.3个月(95%CI:5.6-8.4)、8.3个月(95%CI:6.8-9.1)和4.2个月(95%CI:4.0-4.4)(详见下图)。
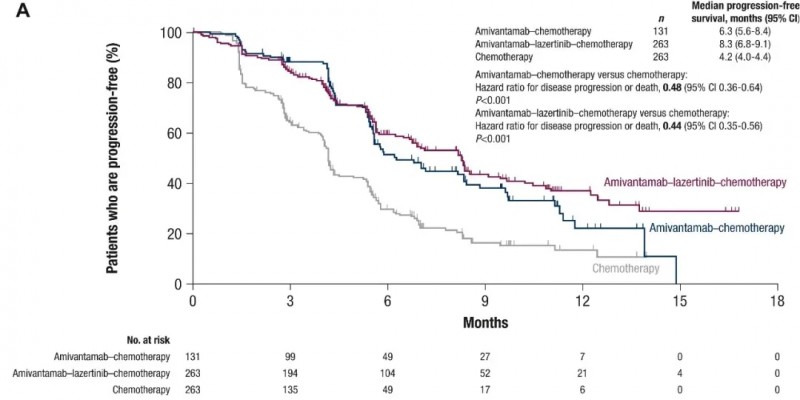
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
09、瑞康曲妥珠单抗
药品名称:注射用瑞康曲妥珠单抗(SHR-A1811)
研发公司:恒瑞医药
作用靶点:HER2
适应证:局部晚期或转移性HER2阳性非小细胞肺癌
药品详情
瑞康曲妥珠单抗(SHR-A1811)是一款HER2靶向的ADC药物,2025年5月29日,注射用瑞康曲妥珠单抗正式在中国获批上市,单药用于存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。
1/2 期临床研究(NCT04818333)结果显示:在所有63 名患者中,客观缓解率(ORR)达到38.1%(95% CI 26.1–51.2)(详见下图),中位PFS 为9.5个月(95% CI 7.1–11.7)。
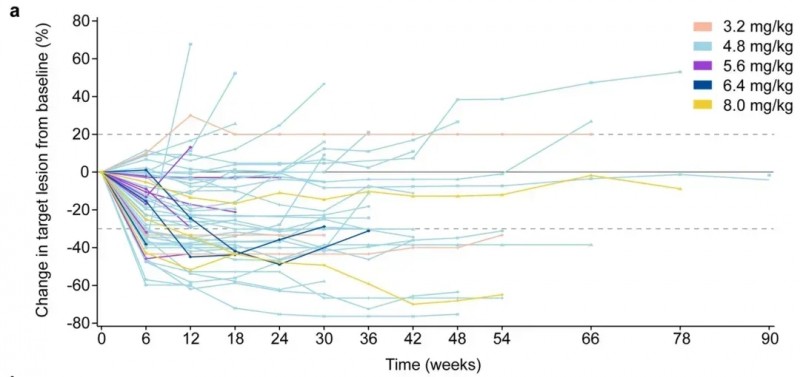
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
10、枸橼酸戈来雷塞片
药品名称:戈来雷塞片(glecirasib,JAB-21822,艾瑞凯®)
研发公司:加科思
作用靶点:KRAS
适应证:KRAS G12C突变型晚期非小细胞肺癌
药品详情
戈来雷塞片是加科思自主研发的一款KRAS G12C抑制剂。2025年5月22日,该药获得中国国家药品监督管理局药品审评中心(NMPA)批准正式上市,用于单药治疗至少接受过一种系统性治疗的KRAS G12C突变型晚期非小细胞肺癌(NSCLC)成人患者。
11、赛沃替尼
药品名称:赛沃替尼(savolitinib,沃瑞沙,ORPATHYS)
研发公司:和黄医药
作用靶点:MET
适应证:非鳞状非小细胞肺癌
药品详情
赛沃替尼是一款选择性MET抑制剂,用于治疗伴有MET外显子14 跳变的局部晚期或转移性非小细胞肺癌成人患者。
2025年6月30日赛沃替尼和奥希替尼(TAGRISSO,osimertinib)联合疗法的新药上市申请获中国国家药品监督管理局(NMPA)批准,用于治疗表皮生长因子受体(EGFR)基因突变阳性经EGFR酪氨酸激酶抑制剂(TKI)治疗后进展的伴MET扩增的局部晚期或转移性非鳞状非小细胞肺癌患者。
临床研究结果显示:沃瑞沙和泰瑞沙的联合疗法降低患者的疾病进展风险达66%,中位PFS为8.2个月,而化疗组则为4.5个月。
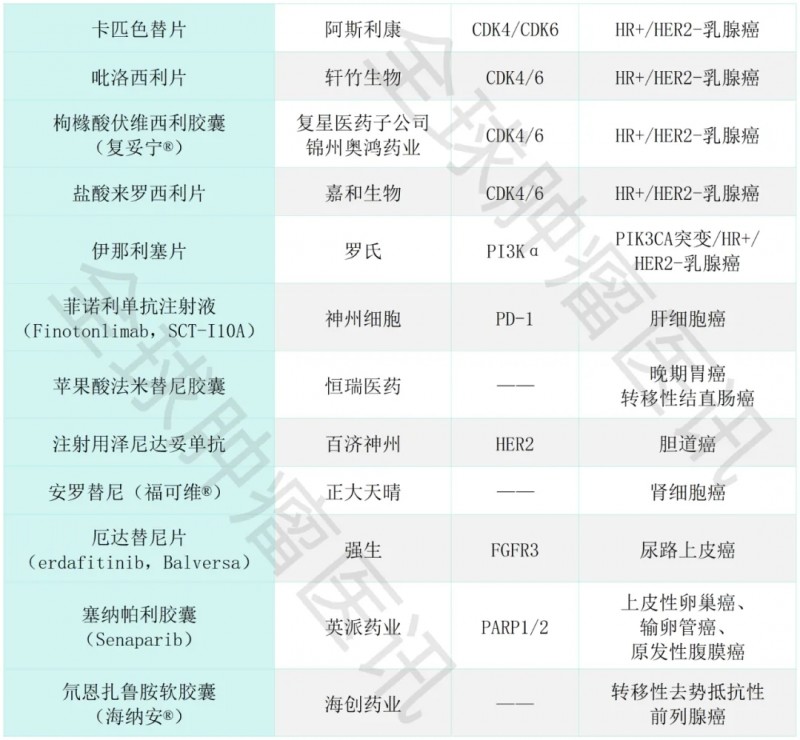
12、卡匹色替片
药品名称:卡匹色替片(Capivasertib,Truqap)
研发公司:阿斯利康
作用靶点:CDK4/CDK6
适应证:HR阳性、HER2阴性的转移性/局部晚期乳腺癌
药品详情
卡匹色替片(Capivasertib,TRUQAP)是一款AKT抑制剂,2025 年 4 月,2025 年 6 月 13 日,正式在中国获批上市,与氟维司群联合,用于成人转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后 12 个月内复发的HR阳性、HER2阴性,且伴有一种或多种 PIK3CA/AKT1/PTEN 改变的局部晚期或转移性乳腺癌的治疗。
此前(2023年11月16日)该药已获得美国FDA批准上市,与氟维司群(Fulvestrant)联合用于成人HR阳性、HER2阴性的转移性/局部晚期乳腺癌的治疗。
13、吡洛西利片
药品名称:吡洛西利片(Bireociclib,商品名:轩悦宁)
研发公司:轩竹生物
作用靶点:CDK4/6
适应证:HR阳性、HER2阴性的晚期或转移性乳腺癌
药品详情
吡洛西利片(Bireociclib,商品名:轩悦宁)是一款新型的CDK4/6选择性抑制剂,同时也是轩竹生物首个获批上市的抗肿瘤创新药。
2025年5月15日,该药的上市申请获国家药品监督管理局(NMPA)批准,用于成人HR阳性、HER2阴性的晚期或转移性乳腺癌的治疗。
该药本次获批主要基于一项BRIGHT-2临床研究(NCT05077449)的惊艳数据,结果显示:意向治疗(ITT)人群中,BF组ORR为39.7%,显著高于F组的13.9%。此外,BF组中位PFS为12.94个月,显著长于F组的7.29个月(详见下图)。
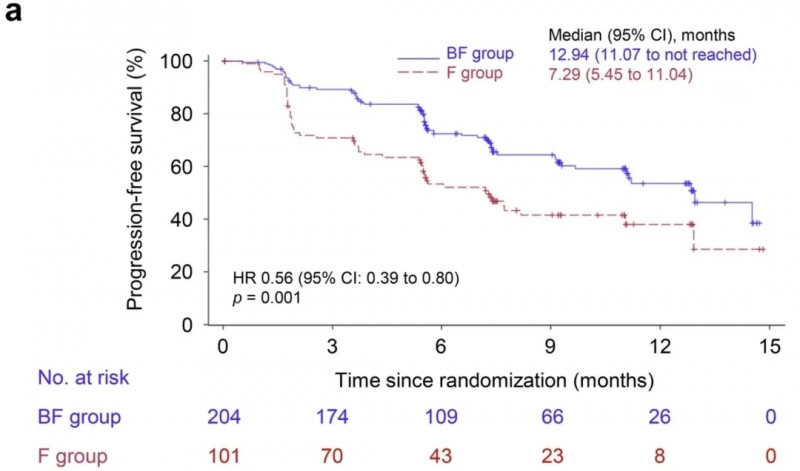
▲图源“Nature Communications”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
14、枸橼酸伏维西利胶囊
药品名称:枸橼酸伏维西利胶囊(复妥宁®)
研发公司:复星医药控股子公司锦州奥鸿药业
作用靶点:CDK4/6
适应证:HR阳性、HER2阴性乳腺癌
药品详情
枸橼酸伏维西利胶囊是一款创新型小分子 CDK4/6 抑制剂,通过抑制细胞周期进程,阻断细胞从 G1 期向 S 期过渡,从而有效减缓癌细胞的增殖速度,还可诱导肿瘤细胞凋亡,达到控制肿瘤发展的目的。
2025 年 5 月 29 日,获得国家药监局批准上市,用于成人既往接受内分泌治疗后出现疾病进展的激素受体(HR)阳性、人表皮生长因子 2(HER2)阴性的复发或转移性乳腺癌的治疗。
15、盐酸来罗西利片
药品名称:盐酸来罗西利片(GB491,Lerociclib)
研发公司:嘉和生物
作用靶点:CDK4、CDK6
适应证:HR+/HER2-的局部晚期或转移性乳腺癌
药品详情
盐酸来罗西利片(GB491,Lerociclib)是一款高选择性口服型CDK4/6抑制剂,对CDK4和CDK6具有高度选择性和强效性,但对CDK9仅具有中度抑制作用。
2024年3月13日,中国国家药品监督管理局(NMPA)已正式受理盐酸来罗西利片的新药上市许可申请,与来曲唑联合,用于既往未经过系统性抗肿瘤治疗的激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性(HR+/HER2-)晚期乳腺癌的治疗。
LEONARDA-1 III期临床研究显示:盐酸来罗西利片(Lerociclib)组的中位无进展生存期(PFS)为11个月,而安慰剂组仅为5.5个月。
16、伊那利塞片
药品名称:伊那利塞片(Inavolisib,Itovebi,GDC-0077)
研发公司:罗氏公司
作用靶点:PI3Kα
适应证:PIK3CA突变、HR阳性、HER2阴性乳腺癌
药品详情
伊那利塞片是一款高选择性PI3Kα抑制剂,是中国首个获批的第三代高选择性PI3Kα抑制剂,同时也是首个获得中美双重突破性疗法认证的HR+乳腺癌治疗产品。2025年3月11日,该药的上市申请获中国国家药品监督管理局(NMPA)批准,与哌柏西利+氟维司群联合,用于内分泌治疗耐药(包括在辅助内分泌治疗期间或之后出现复发)、PIK3CA突变、HR(激素受体)阳性、HER2(人表皮生长因子受体2)阴性的局部晚期或转移性乳腺癌成人患者的治疗。
伊那利塞片本次获批,主要基于一项3期INAVO120临床研究(NCT04191499)数据。结果显示:Inavolisib(伊那利塞片)组的客观缓解率(ORR)高达58.4%,而安慰剂组仅为25.0%,伊那利塞片将客观缓解率足足提高了33.4个百分点(详见下图)。此外,Inavolisib将患者的中位无进展生存期(PFS)提高近一倍,分别为15.0个月(Inavolisib组) vs 7.3个月(安慰剂组)。
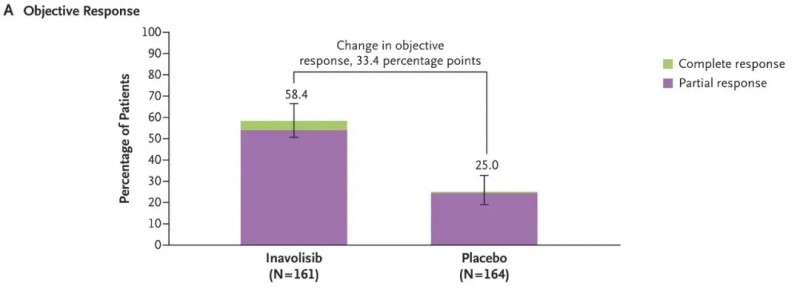
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
17、菲诺利单抗注射液
药品名称:菲诺利单抗注射液(Finotonlimab,SCT-I10A)
研发公司:神州细胞
作用靶点:PD-1
适应证:肝细胞癌
药品详情
菲诺利单抗注射液(Finotonlimab,SCT-I10A)是神州细胞自主研发的一款重组人源化抗PD-1 IgG4型单克隆抗体注射液。
2025年2月28日,菲诺利单抗注射液(SCT-I10A)与贝伐珠单抗注射液(SCT510)联合疗法,获中国国家药品监督管理局(NMPA)批准,用于既往未接受过系统治疗的不可切除或转移性肝细胞癌治疗。
18、苹果酸法米替尼胶囊
药品名称:苹果酸法米替尼胶囊
研发公司:恒瑞医药
适应证:晚期胃癌、转移性结直肠癌
药品详情
苹果酸法米替尼胶囊是一种新型小分子多靶点酪氨酸激酶抑制剂,在多种实体瘤治疗中展现出潜力。目前已在国内获批的适应症包括晚期胃癌(三线治疗)、转移性结直肠癌(三线治疗)等,用于既往接受过标准化疗后进展或复发的患者。
19、注射用泽尼达妥单抗
药品名称:泽尼达妥单抗(Zanidatamab,ZW 25)
研发公司:百济神州
作用靶点:HER2
适应证:胆道癌
药品详情
泽尼达妥单抗(Zanidatamab)是一款针对HER2的双特异性抗体。2025年5月29日,注射用泽尼达妥单抗的上市申请获得中国NMPA批准,用于既往接受过全身治疗的HER2高表达(IHC3+)的不可切除局部晚期或转移性胆道癌的治疗。
本次获批主要基于一项2b期HERIZON-BTC-01(NCT04466891)临床研究的突破性数据,结果显示:在队列1(n=80)中,独立中央审查(ICR)评估的客观缓解率(ORR)为41.3%,中位缓解持续时间(DOR)长达12.9个月。
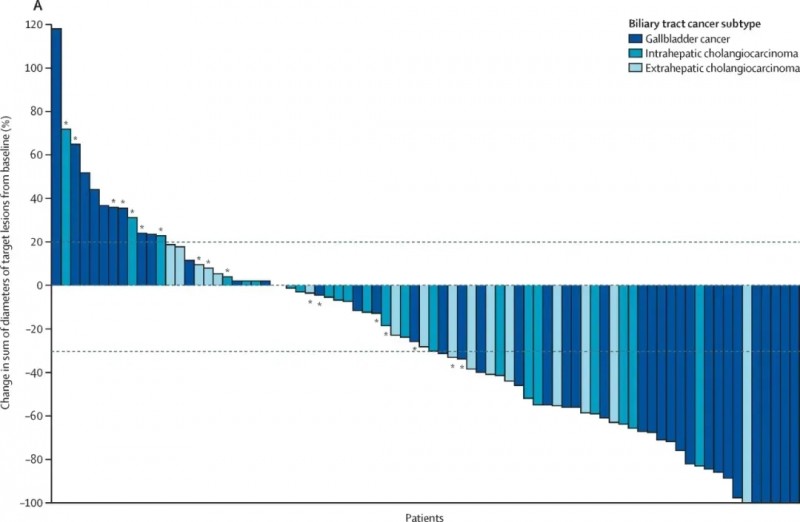
▲图源“THE LANCET”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
20、安罗替尼
药品名称:安罗替尼(福可维®)
研发公司:正大天晴
适应证:肾细胞癌
药品详情
安罗替尼是我国自主研发的一种新型小分子多靶点酪氨酸激酶抑制剂(TKI),具有抗血管生成和抑制肿瘤生长的双重作用,在多种实体瘤治疗中应用广泛。2025年5月21日,中国国家药品监督管理局(NMPA)重磅宣布:安罗替尼与贝莫苏拜单抗联合疗法正式获批上市,用于晚期不可切除或转移性肾细胞癌(RCC)一线治疗。
该联合疗法的ETER100 III期临床研究(NCT04523272)数据,结果显示:联合治疗组展现出显著临床优势,中位无进展生存期(PFS)分别为18.96个月(联合治疗组) vs 9.76个月(舒尼替尼单药治疗组,HR=0.53,p<0.0001)。此外,联合治疗组的总缓解率高达71.6%,显著高于舒尼替尼单药治疗组的25.1%(详见下图)。
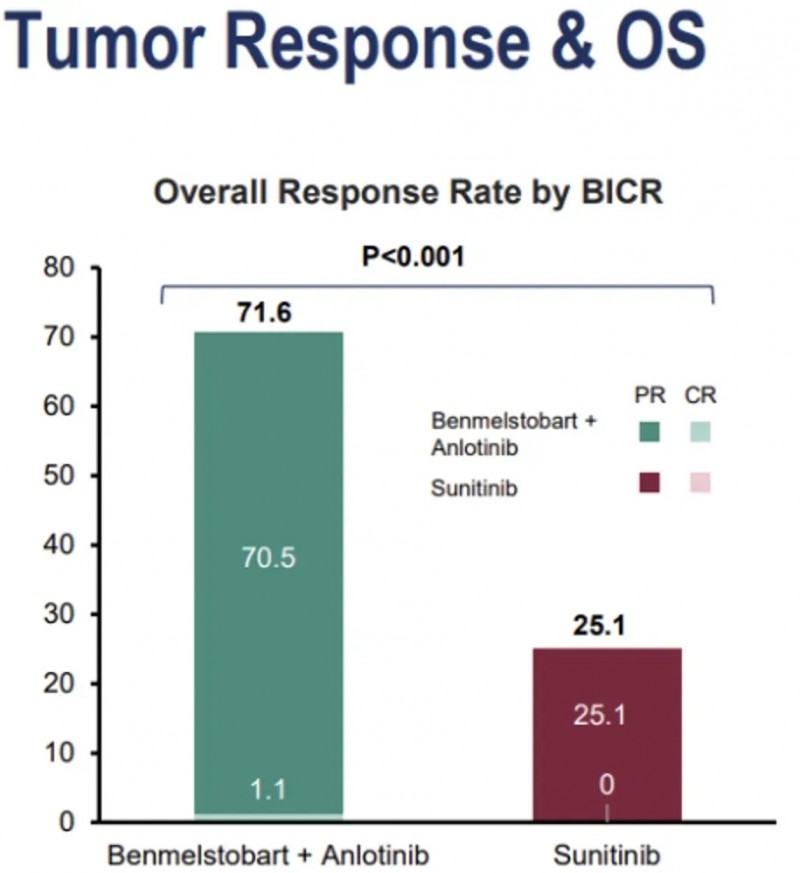
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
21、厄达替尼片
药品名称:厄达替尼片(erdafitinib,Balversa)
研发公司:强生
作用靶点:FGFR3
适应证:尿路上皮癌。
药品详情
厄达替尼片是一种全成纤维细胞生长因子受体(FGFR)抑制剂,具备显著的抗肿瘤活性。主要通过抑制FGFR的活性,切断肿瘤细胞的生长信号传导路径,进而对抗恶性肿瘤。
2025年1月13日,厄达替尼片的上市申请获中国国家药品监督管理局(NMPA)批准,用于携带易感型FGFR3基因突变、既往接受至少一线含抗PD-1或抗PD-L1期间或之后,病情进展且手术不可切除的局部晚期或转移性尿路上皮癌(UC)成人患者的治疗。
此前该药曾先后两次获美国FDA批准,用于成人在接受铂基化疗后,病情仍持续进展的局部晚期或转移性膀胱癌(2019年4月)、成人易感FGFR3/2变异,且在含铂化疗后病情出现进展的局部晚期或转移性尿路上皮癌(2024年1月)。
厄达替尼在中国的顺利获批,主要基于全球3期临床试验(THOR)的优异数据。结果显示:厄达替尼组的客观缓解率(ORR)为45.6%,显著高于化疗组的11.5%(详见下图),其中9例患者(占比6.6%)达到完全缓解(CR);在生存获益方面,厄达替尼组的中位无进展生存期(PFS)为5.6个月,长于化疗组的2.7个月,中位总生存期(OS)则为12.1个月,显著优于化疗组的7.8个月。
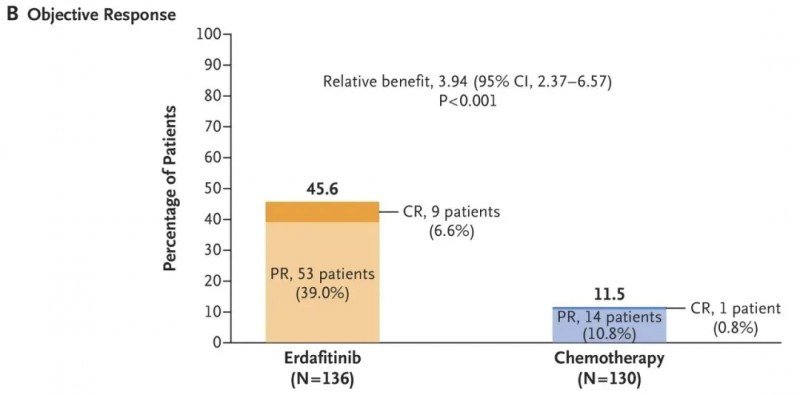
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
22、塞纳帕利胶囊
药品名称:塞纳帕利(Senaparib)
研发公司:英派药业
作用靶点:PARP1/2。
适应证:上皮性卵巢癌、输卵管癌、原发性腹膜癌。
药品详情
塞纳帕利(Senaparib)是由英派药业自主研发的一款新型、高效的PARP1/2抑制剂,具有独特的分子结构,使其具备体外和体内高活性,以及高靶向选择性和广泛的安全窗口。
2025年1月16日,该药的上市申请获得NMPA批准上市,用于成人晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌在一线含铂化疗达到完全缓解或部分缓解后的维持治疗。
23、氘恩扎鲁胺软胶囊
药品名称:氘恩扎鲁胺软胶囊(海纳安®)
研发公司:海创药业
适应证:转移性去势抵抗性前列腺癌
药品详情
氘恩扎鲁胺软胶囊是我国自主研发的 1 类抗癌新药,同时也是第二代雄激素受体(AR)抑制剂恩扎卢胺的氘代药物,可竞争性抑制雄激素与其受体的结合,并可抑制雄激素受体的核转运和雄激素受体与 DNA 的相互作用,从而发挥抗癌作用。
2025 年 5 月末,氘恩扎鲁胺软胶囊获得国家药监局批准上市,6 月 20 日开出全国首张处方用于成人接受醋酸阿比特龙及化疗后出现疾病进展,且既往未接受新型雄激素受体抑制剂的转移性去势抵抗性前列腺癌(mCRPC)的治疗。
小编寄语
一种新药从开始申请,到最终应用于患者平均需要5年左右的时间;如果再算上纳入医保目录的时间,则需6~8年。值得欣慰的是,近年我国推出了多种抗癌救命药的改革方案,大大加速了国内抗癌新药的上市速度!小编也希望随着越来越多的抗癌新药获批并纳入医保范畴,能惠及更多的癌症患者!此外,“方舟援助计划”也可为癌友们提供上市/未上市新药的免费治疗机会。
对现有治疗方案不满意或想参加方舟计划获得免费用药机会的患者,可将出院小结、近期病理及基因检测报告等资料,提交至医学部,进行初步评估。
参考资料
[1]Lesokhin A M,et al.Elranatamab in relapsed or refractory multiple myeloma: phase 2 MagnetisMM-3 trial results[J]. Nature medicine, 2023, 29(9): 2259-2267.
https://www.nature.com/articles/s41591-023-02528-9
[2]Passaro A,et al.Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study[J]. Annals of Oncology, 2024, 35(1): 77-90.
https://www.annalsofoncology.org/article/S0923-7534(23)04281-3/fulltext
[3]Wang J,et al.Bireociclib plus fulvestrant for HR+/HER2-advanced female breast cancer progressed on or after endocrine therapy: phase 3 BRIGHT-2 study interim analysis[J]. Nature Communications, 2025, 16(1): 3350.
https://www.nature.com/articles/s41467-025-58647-z
[4]Turner N C,et al.Inavolisib-based therapy in PIK3CA-mutated advanced breast cancer[J]. New England Journal of Medicine, 2024, 391(17): 1584-1596.
https://www.nejm.org/doi/full/10.1056/NEJMoa2404625
[5]https://www.urotoday.com/conference-highlights/esmo-2024/esmo-2024-kidney-cancer/154845-esmo-2024-anlotinib-combined-with-anti-pd-l1-antibody-benmelstobart-tqb2450-versus-sunitinib-in-first-line-treatment-of-advanced-renal-cell-carcinoma-rcc-a-randomized-open-label-phase-iii-study-eter100.html
[6]Loriot Y,et al.Erdafitinib or chemotherapy in advanced or linkstatic urothelial carcinoma[J]. New England Journal of Medicine, 2023, 389(21): 1961-1971.
https://www.nejm.org/doi/full/10.1056/NEJMoa2308849












