2024岁末我国强势获批11款抗癌新药/适应证,惠及肺癌、乳腺癌、妇瘤等十类癌症患者
小编 2024-12-06
2024岁末我国强势批准11种癌症新药/新适应证,惠及肺癌、乳腺癌、妇瘤等十类癌症患者
2024年即将步入尾声之际,一则令人心潮澎湃的喜讯从中国国家药品监督管理局(NMPA)官网传来!就在刚刚过去的短短数周时间里,我们又迎来了多款抗癌新药/新适应证获批上市的好消息,这些新药犹如破晓曙光,精准覆盖了乳腺癌、非小细胞肺癌、小细胞肺癌、子宫内膜癌、肾细胞癌、卵巢癌等诸多癌症类型。
每一款新药的获批,都如同一座坚实的里程碑,奋力撕开了病痛的一角,为无数在癌症阴影中苦苦挣扎的患者们,带来了新的曙光与选择!下面全球肿瘤医生网小编就为大家简单盘点一下近期获批的这些新药,以供癌友们参考。
七大类抗癌新药新近获批,点亮生命新曙光
注射用芦康沙妥珠单抗
药品简介
药物名称:芦康沙妥珠单抗(Sacituzumab Tirumotecan,sac-TMT,SKB264,佳泰莱®)。
研发公司:科伦博泰生物。
获批时间:2024年11月27日。
药品信息
芦康沙妥珠单抗是我国首个获完全批准上市的国产ADC药物,同时也是首个在中国获批上市的国产TROP2 ADC药物!2024年11月27日,获国家药品监督管理局(NMPA)批准,用于成人既往接受过至少2种系统治疗(包括至少1种针对晚期或转移性阶段的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌的治疗。

▲截图源自“NMPA”
本次获批主要基于一项Ⅲ期OptiTROP-Breast01临床研究(NCT05347134)的惊艳数据,客观缓解率(ORR)达到43.8%,无进展生存期(PFS)显著改善至5.7个月,而单纯化疗组ORR仅为12.8%。
除了乳腺癌外,芦康沙妥珠单抗还有其他适应证获批在即,为EGFR突变的局部晚期或转移性非小细胞肺癌(既往接受EGFR-TKI+含铂化疗失败,或经EGFR-TKI治疗后病情进展),让我们拭目以待!
适应证
用于既往至少接受过2种系统治疗(其中至少1种治疗针对晚期或转移性阶段)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。
格索雷塞
药品简介
药物名称:格索雷塞片(Garsorasib,D-1553,安方宁®️)。
研发公司:正大天晴。
获批时间:2024年11月8月。
治疗靶点:KRAS G12C。
药品信息
格索雷塞片是我国第二款KRAS G12C抑制剂,2024年11月8日获中国国家药品监督管理局(NMPA)批准上市,用于既往至少接受过一种系统性治疗的KRAS G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者的治疗。

▲截图源自“NMPA”
本次获批主要是基于D1553-102的关键II期临床研究的卓越数据。格索雷塞的客观缓解率(ORR)达到52.0%,疾病控制率(DCR)更是高达88.6%。其中1例幸运患者的靶病灶全部消失,评效达到完全缓解(CR)!此外,中位总生存期(OS)长达14.1个月,中位无进展生存期(PFS)较之前延长至9.1个月。
适应证
用于治疗至少接受过一种系统性治疗的KRAS-G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者。
注射用芦比替定
药品简介
药物名称:注射用芦比替定(Lurbinectedin)。
研发公司:绿叶制药(引进)。
获批时间:2024年12月3日。
药品信息
芦比替定是一种选择性的致癌基因转录抑制剂,2024年12月3日,该药获中国NMPA批准上市,用于成人铂类化疗中/化疗后病情进展的小细胞肺癌(SCLC)的治疗。此前,该药已在美国、中国香港及澳门等地相继获批上市。
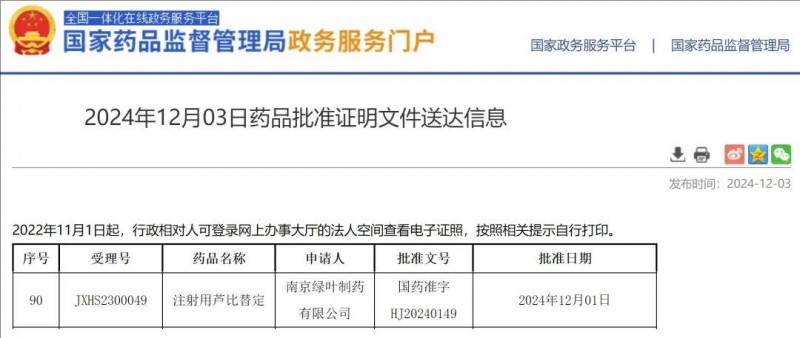
▲截图源自“NMPA”
根据中国的关键桥接研究(NCT04638491)数据显示,芦比替定的客观缓解率(ORR)高达45.5%,中位无进展生存期(PFS)为5.6个月,中位总生存期(OS)长达11.0个月。
适应证
用于铂类化疗中/化疗后病情进展的小细胞肺癌(SCLC)成年患者的治疗。
索米妥昔单抗注射液
药品简介
药物名称:索米妥昔单抗注射液(HDM2002,ELAHERE®)。
研发公司:华东医药。
获批时间:2024年11月27日。
药品信息
索米妥昔单抗是首个针对FRα(叶酸受体α)阳性卵巢癌的ADC药物,2024年11月27日,获中国NMPA批准上市,用于成人既往接受过1~3种系统治疗的FRα阳性铂类耐药的上皮性卵巢癌、原发性腹膜癌、输卵管癌的治疗。本次获批主要基于2024年欧洲肿瘤内科学会(ESMO)大会上公布的III期MIRASOL临床研究的惊艳数据,索米妥昔单抗组的中位总生存期(OS)长达16.5个月,中位无进展生存期(PFS)为5.6个月。

▲截图源自“NMPA”
此前,该药已获美国FDA批准上市(2022年11月),用于经1-3线全身治疗的铂耐药的FRα阳性卵巢上皮性癌、输卵管癌、原发性腹膜癌,该药是首个且目前唯一获美国FDA批准的用于治疗此类恶性肿瘤的ADC药物(即抗体偶联药物)。
适应证
用于既往接受过1~3种系统治疗的FRα阳性铂类耐药的上皮性卵巢癌、原发性腹膜癌、输卵管癌的成年患者。
佐利替尼
药品简介
药物名称:佐利替尼(Zorifertinib,AZD3759,泽瑞尼®)。
研发公司:阿斯利康研发,晨泰医药引进。
获批时间:2024年11月20日。
治疗靶点:EGFR。
药品信息
佐利替尼是一种新型表皮生长因子受体酪氨酸激酶(EGFR-TKI)抑制剂,具有出色的血脑屏障穿透能力。2024年11月20日,获中国NMPA批准上市,用于成人伴中枢神经系统(CNS)转移的局部晚期或转移性非小细胞肺癌(NSCLC)的一线治疗。
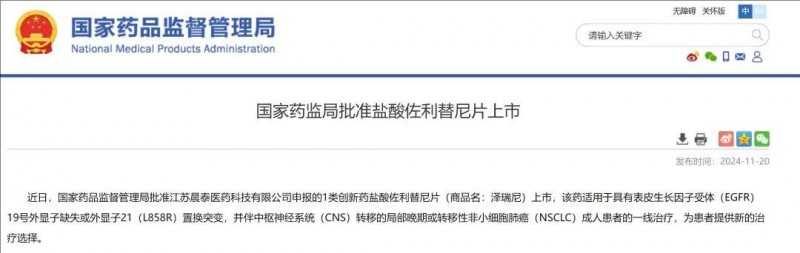
▲截图源自“NMPA”
佐利替尼的Ⅲ期EVEREST试验(NCT03653546)结果,凸显了其不同于其他EGFR-TKI抑制剂的优越的血脑屏障穿透能力,佐利替尼组的中位无进展生存期(PFS)显著延长,达到9.6个月;颅内中位PFS更是长达15.2个月。
适应证
用于伴中枢神经系统(CNS)转移的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
贝组替凡片
药品简介
药物名称:贝组替凡片(Belzutifan)。
研发公司:默沙东。
获批时间:2024年11月21日。
药品信息
贝组替凡片是一种选择性HIF-2α(缺氧诱导因子2α)抑制剂,2024年11月21日,在中国获批,用于无需立即手术的希佩尔-林道综合征(VHL)相关的肾细胞癌、胰腺神经内分泌瘤、中枢神经系统血管母细胞瘤的治疗。

▲截图源自“NMPA”
《新英格兰杂志》报道了该药的3期临床试验结果,贝组替凡组的客观缓解率(ORR)达到21.9%,中位总生存期(OS)长达21.4个月,18个月的总生存率高达55.2%。
贝组替凡片还曾在2021年8月、2023年12月两度获美国药品食品监督管理局(FDA)批准上市,用于既往接受过抗VEGF、PD-(L)1药物治疗的晚期肾细胞癌(RCC)。
适应证
适用于无需立即手术的希佩尔-林道综合征(VHL)相关的肾细胞癌、胰腺神经内分泌瘤、中枢神经系统血管母细胞瘤。
信迪利单抗+呋喹替尼
药品简介
药物名称:信迪利单抗+呋喹替尼。
研发公司:信达公司、和黄医药。
获批时间:2024年12月3日。
药品信息
信迪利单抗是一种抗PD-1单克隆抗体,而呋喹替尼是一种高度选择性的VEGFR抑制剂。2024年12月3日,信迪利单抗与呋喹替尼联合疗法获中国NMPA批准,用于治疗晚期错配修复完整(pMMR1)或非微卫星高度不稳定(非MSI-H2)子宫内膜癌,这些患者既往曾接受过系统性抗肿瘤治疗后,病情进展且不适合进行根治性手术或放疗。
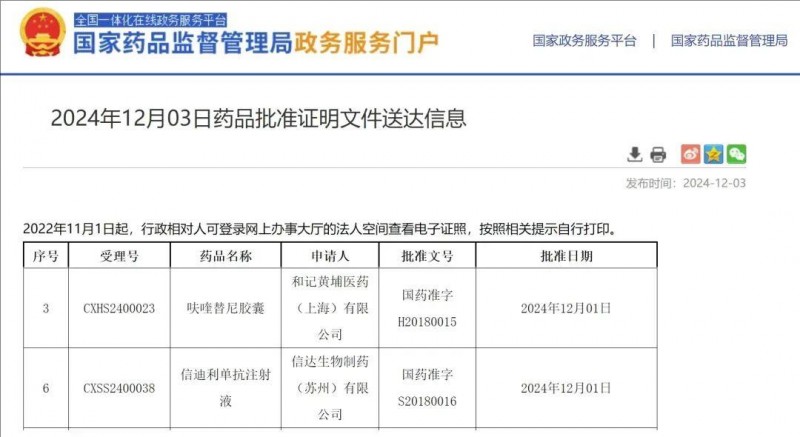
▲截图源自“NMPA”
本次获批主要基于2024年美国临床肿瘤学会(ASCO)公布的一项KEYNOTE-775临床研究的震撼数据,信迪利单抗与呋喹替尼联合治疗晚期子宫内膜癌(EMC)的客观缓解率(ORR)为35.6%,中位总生存期(OS)长达21.3个月,中位无进展生存期(PFS)达到9.5个月。
适应证
既往接受过系统性抗肿瘤治疗后病情进展,且不适合进行根治性手术/放疗的晚期错配修复完整(pMMR1)或非微卫星高度不稳定(非MSI-H2)子宫内膜癌。
四大抗癌药新适应证获批,开启抗癌新征程
氟唑帕利
药品简介
药物名称:氟唑帕利胶囊(Fluzoparib,艾瑞颐®)。
研发公司:恒瑞医药。
获批时间:2024年12月2日。
治疗靶点:PARP1、PARP-2。
药品信息
氟唑帕利胶囊是第一款国产PARP抑制剂,同也是我国首个获批治疗乳腺癌的PARP抑制剂!2024年12月2日,氟唑帕利的新适应证获中国NMPA批准,用于伴胚系BRCA突变(gBRCAm)的HER2阴性乳腺癌的治疗(氟唑帕利单药或与甲磺酸阿帕替尼联合)。
本次获批主要基于2024年欧洲肿瘤内科学会(ESMO)上公布的FABULOUS临床研究的惊艳数据。与标准化疗相比,氟唑帕利单药治疗或与甲磺酸阿帕替尼联合治疗,均显著改善了患者的中位无进展生存期(mPFS)。mPFS分别为11.0个月(氟唑帕利+阿帕替尼联合治疗组)、6.7个月(氟唑帕利单药组)、3.0个月(标准化疗组)。客观缓解率(ORR)分别为43.6%(氟唑帕利单药组)、67.3%(氟唑帕利联合治疗组)、23.3%(标准化疗组)。
值得一提的是,该药还被纳入了2024年的医保范畴。
获批新适应证
单药或与甲磺酸阿帕替尼联合,用于伴胚系BRCA突变(gBRCAm)的HER2阴性乳腺癌的治疗。
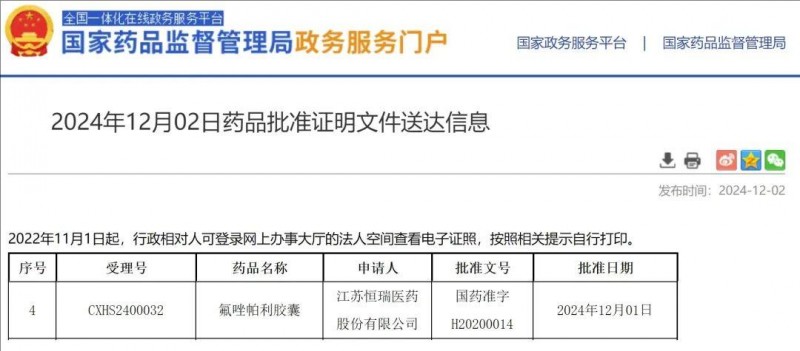
▲截图源自“NMPA”
既往获批适应证
此前氟唑帕利已在中国获批了三项适应证,分别为:
1、既往经≥2线化疗的伴gBRCAm突变的铂敏感复发性卵巢癌、原发性腹膜癌、输卵管癌(2020年12月);
2、成人铂敏感的复发性上皮性卵巢癌、原发性腹膜癌、输卵管癌(维持治疗,2021年6月);
3、晚期上皮性卵巢癌、原发性腹膜癌、输卵管癌,一线含铂化疗达到完全缓解或部分缓解后的维持治疗(2024年5月)。
斯鲁利单抗注射液
药品简介
药物名称:斯鲁利单抗注射液(Serplulimab,HLX10,汉斯状®,H药)。
研发公司:复宏汉霖。
获批时间:2024年12月3日。
药品信息
斯鲁利单抗是我国自研的一款创新型PD-1药物,以及首个获批用于治疗小细胞肺癌的国研PD-1药物,同时也是首个国产的泛癌种PD-1药物!
2024年12月3日,斯鲁利单抗注射液的新适应症获中国NMPA批准,与卡铂+培美曲塞联合,一线治疗局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)(EGFR敏感性突变阴性及ALK基因重排阴性)。
本次获批主要基于一项3期临床研究(ASTRUM-004)的惊艳数据,与安慰剂化疗相比,斯鲁利单抗联合化疗显著改善了晚期鳞状非小细胞肺癌的中位总生存期(OS)、中位无进展生存期(PFS),并将疾病进展或死亡风险降低47%,可带来长期生存益处。
1、中位OS分别为22.7个月(斯鲁利单抗联合化疗组) vs 18.2个月(安慰剂+化疗组)(详见下图)。24个月时的总生存率分别为47.4%(斯鲁利单抗联合化疗组) vs 34.4%(安慰剂+化疗组)。
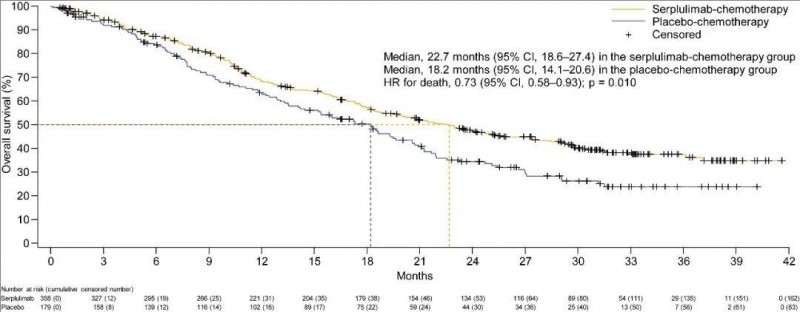
▲图源“Cancer Cell”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、中位PFS分别为8.3个月(斯鲁利单抗联合化疗组) vs 5.7 个月(安慰剂+化疗组)(详见下图)。
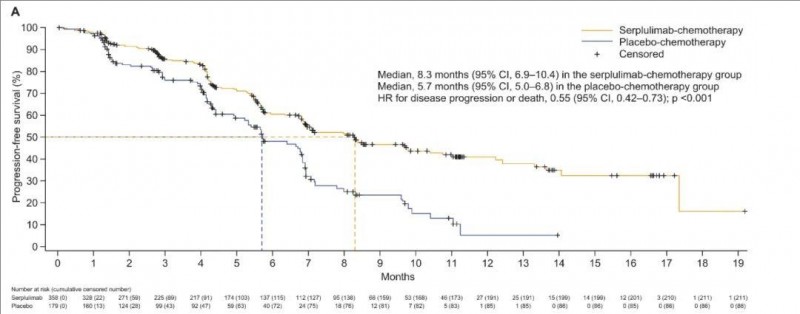
▲图源“Cancer Cell”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
获批新适应证
与卡铂+培美曲塞联合,用于EGFR阴性、ALK阴性的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗。

▲截图源自“NMPA”
既往获批适应证
斯鲁利单抗此前已在中国获批四个适应证,分别为:
1、2022年3月24日,在我国首次获批,用于经标准治疗失败后、不可切除、转移性的高度微卫星不稳定型(MSI-H)实体瘤(斯鲁利单抗单药治疗)。
2、斯鲁利单抗与卡铂+白蛋白紫杉醇联合,用于局部晚期或转移性鳞状非小细胞肺癌(NSCLC)的一线治疗(2022年10月31日)。
3、斯鲁利单抗与卡铂+依托泊苷联合,用于小细胞肺癌的一线治疗(2023年1月)。
4、斯鲁利单抗与卡铂+氟尿嘧啶联合,用于食管鳞癌的一线治疗(2023年9月)。
帕博利珠单抗
药品简介
药物名称:帕博利珠单抗(派姆单抗,pembrolizumab,Keytruda)。
研发公司:默沙东(MSD)。
获批时间:2024年12月3日。
治疗靶点:PD-1。
药品信息
帕博利珠单抗是中国首个获批上市的PD-1抑制剂!2024年12月3日,其新适应证在中国获批,与含铂化疗联合,并在术后继续帕博利珠单抗单药辅助治疗,用于可手术切除的II、IIIA及IIIB期非小细胞肺癌(NSCLC)的治疗。
本次获批主要是基于《柳叶刀》报道的一项Ⅲ期KEYNOTE-671临床研究结果,帕博利珠单抗治疗早期非小细胞肺癌,3年总生存(OS)率高达71%,中位无事件生存率(EFS)更是长达47.2个月!
获批新适应证
联合含铂化疗新辅助治疗,并在术后继续帕博利珠单抗单药辅助治疗,用于可手术切除的II、IIIA及IIIB期非小细胞肺癌(NSCLC)。

▲截图源自“NMPA”
既往获批适应证
帕博利珠单抗号称“K药卷王”,除了本次获批的适应证外,还曾获批用于治疗头颈部鳞状细胞癌(HNSCC)、胃癌、乳腺癌、其他非小细胞肺癌等多款实体瘤。
贝莫苏拜单抗
药品简介
药物名称:贝莫苏拜单抗(Benmelstobart,TQB2450,安得卫®)。
研发公司:正大天晴。
获批时间:2024年11月27日。
药品信息
贝莫苏拜单抗是一款人源化PD-L1单克隆抗体的1类创新药,2024年11月27日,该药的新适应证获中国NMPA批准,与盐酸安罗替尼胶囊联合,用于既往接受过一、二线化疗方案治疗失败或不能耐受治疗的非DNA错配修复缺陷(非dMMR)或非微卫星高度不稳定(非MSI-H)的复发性或转移性子宫内膜癌的治疗。
本次获批主要基于2024国际妇科肿瘤学会(IGCS)年会上公布的一项Ⅱ期ETER200临床研究的振奋数据!贝莫苏拜单抗联合安罗替尼治疗晚期、复发或转移性子宫内膜癌(EC),疾病控制率(DCR)高达77.7%,客观缓解率(ORR)达34.12%。中位总生存期(mOS)长达21.78个月,中位无进展生存期(mPFS)达8.80个月。
获批新适应证
用于非DNA错配修复缺陷(非dMMR)或非微卫星高度不稳定(非MSI-H)的复发性或转移性子宫内膜癌的治疗,且既往接受过一、二线化疗方案治疗失败或不能耐受治疗的患者。

▲截图源自“NMPA”
既往获批适应证
2024年5月,贝莫苏拜单抗在中国获批,与安罗替尼及化疗药(卡铂、依托泊苷)联合,用于广泛期小细胞肺癌(ES-SCLC)的一线治疗,这是该药在我国获批的首个适应证!
小编寄语
上文提到的近期获批上市的抗癌新药/新适应证,只是众多在研抗癌药的冰山一角,但这微小的一角,已然为癌症患者带来了新的曙光!我们也期望随着越来越多抗癌新药的相继获批,并逐步纳入医保范畴,为更多癌症患者带来新的希望与选择!
好消息是,目前我国有多款在研药物已相继开展临床试验,这也意味着中国患者将有免费获得最新抗癌药物治疗的机会。同时,“方舟援助计划”也可为患者提供上市及未上市新药的免费治疗机会。对现有治疗方案不满意的癌友,可将治疗经历、出院小结、近期影像及病理检查结果等资料,提交至医学部,进行初步评估或了解详细的入排标准。
参考资料
[1]Choueiri T K,et al.Belzutifan versus everolimus for advanced renal-cell carcinoma[J]. New England Journal of Medicine, 2024, 391(8): 710-721.
https://www.nejm.org/doi/full/10.1056/NEJMoa2313906
[2]Zhou C,et al.A global phase 3 study of serplulimab plus chemotherapy as first-line treatment for advanced squamous non-small-cell lung cancer (ASTRUM-004)[J]. Cancer cell, 2024, 42(2): 198-208. e3.
https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00432-4?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1535610823004324%3Fshowall%3Dtrue
[3]https://www.nmpa.gov.cn/












