2024年1月30日国家药监局批准帕博利珠单抗注射液(Pembrolizumab、可瑞达/Keytruda)联合吉西他滨和顺铂用于一线治疗局部晚期或转移性胆道癌
小编 2024-09-20
2024年1月30日国家药监局批准帕博利珠单抗注射液(Pembrolizumab、可瑞达/Keytruda)联合吉西他滨和顺铂用于一线治疗局部晚期或转移性胆道癌
2024年1月30日,中国国家药品监督管理局(NMPA)批准PD-1抑制剂帕博利珠单抗注射液(Pembrolizumab、可瑞达/Keytruda)联合吉西他滨和顺铂化疗(GC方案)用于局部晚期或转移性胆道癌(BTC)患者的一线治疗。这一里程碑式的突破为BTC患者带来了新的希望,标志着免疫治疗在BTC领域的重大进展。
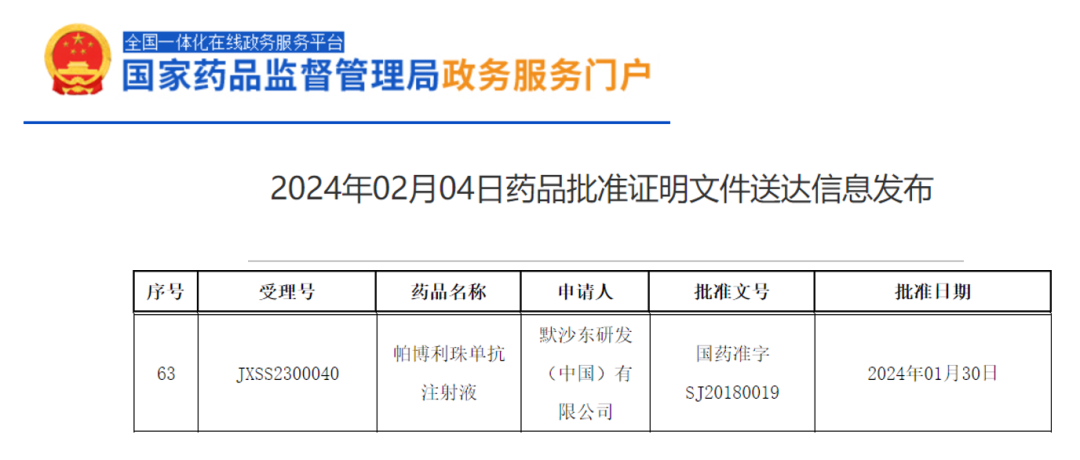
获批依据
帕博利珠单抗联合GC方案的此次获批的主要依据是KEYNOTE-966研究,这是一项设计严谨、结果可靠的全球多中心、随机、双盲、安慰剂对照的III期临床试验,旨在评估帕博利珠单抗联合GC方案对比GC方案一线治疗晚期或不可切除BTC患者的疗效和安全性。
研究设计:
研究人群:纳入1069例BTC患者,年龄≥18岁,既往未接受过全身治疗,ECOG评分0-1分,预期寿命超过3个月。
随机分组:按1:1比例随机分配至帕博利珠单抗组和安慰剂组。
治疗方案:
帕博利珠单抗组:帕博利珠单抗200 mg,每3周一次,最多持续35次,联合GC方案(吉西他滨1000mg/m²,d1、d8,q3w;顺铂25mg/m²,d1、d8,q3w)。
安慰剂组:安慰剂+GC方案。
分层因素:地理区域(亚洲 vs. 非亚洲)、分期(局部晚期 vs. 转移)、肿瘤起源部位(胆囊 vs. 肝内 vs. 肝外)。
主要终点:意向治疗(ITT)人群的总生存期(OS)。
次要终点:ITT人群的无进展生存期(PFS)、客观缓解率(ORR)、缓解持续时间(DoR)和安全性。
研究数据截止日期:2023年4月13日。
研究结果显示:
OS显著改善:帕博利珠单抗组中位OS为12.7个月,安慰剂组为10.9个月,死亡风险降低17%(HR 0.83,95%CI 0.72-0.95,p=0.0034)。两组12个月OS率分别为52%和44%,24个月OS率分别为25%和19%。
PFS和DoR获益:帕博利珠单抗组中位PFS为6.5个月,安慰剂组为5.6个月;中位DoR为8.3个月,安慰剂组为6.9个月。
ORR略有提升:帕博利珠单抗组ORR为28.9%,安慰剂组为28.5%。
安全性良好:两组3-4级不良事件发生率分别为79%和75%,未发现新的安全性信号。
亚组分析:
●在PD-L1 CPS≥1、CPS≥10、CPS≥20亚组中,帕博利珠单抗组均显示出显著的OS获益。
●在肝外胆管癌、肝内胆管癌、胆囊癌亚组中,帕博利珠单抗组均显示出显著的OS获益。
●在亚洲和非亚洲人群中,帕博利珠单抗组均显示出显著的OS获益。
安全性分析:
●两组3-4级不良事件发生率分别为79%和75%,包括中性粒细胞计数下降、贫血、恶心、血小板计数下降、疲劳、便秘、食欲下降、白细胞计数降低、发热、呕吐、腹泻、腹痛、皮疹、天冬氨酸转氨酶升高、丙氨酸转氨酶升高、低镁血症、瘙痒症、乏力、外周水肿等。
●两组3-4级免疫介导不良反应发生率分别为7%和4%,包括肺炎、结肠炎、肝炎、甲状腺功能减退、垂体炎、肾上腺皮质功能减退等。
●两组因不良事件停止治疗的患者比例分别为7%和7%。
结论:
KEYNOTE-966研究结果证实,帕博利珠单抗联合GC方案可显著延长BTC患者的生存期,改善预后,且安全性良好,该研究结果为帕博利珠单抗联合GC方案在BTC一线治疗中的应用提供了强有力的证据支持。
帕博利珠单抗在中国获批的适应症
帕博利珠单抗自2018年在中国获批上市以来,已陆续获得多个适应症的批准,为多种肿瘤患者带来了新的治疗选择。以下是帕博利珠单抗在中国获批的适应症及其对应的时间:
黑色素瘤
2018年7月20日:获批用于经一线治疗失败的不可切除或转移性黑色素瘤。
非小细胞肺癌
2019年3月29日:获批联合培美曲塞和铂类化疗用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗。
2019年10月24日:获批用于由NMPA批准的检测评估为PD-L1肿瘤比例分数(TPS)≥1%的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的局部晚期或转移性非小细胞肺癌(NSCLC)一线单药治疗。
2019年11月25日:获批联合卡铂和紫杉醇适用于转移性鳞状非小细胞肺癌(NSCLC)一线治疗。
食管癌
2020年6月22日:获批单药用于通过充分验证的检测评估肿瘤表达PD-L1 CPS≥10,既往一线全身治疗失败的、局部晚期或转移性食管鳞状细胞癌(ESCC)患者的二线治疗。
2021年9月3日:获批用于食管癌全人群一线治疗。
头颈部鳞状细胞癌
2020年12月9日:获批单药用于通过充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥20)的转移性或不可切除的复发性头颈部鳞状细胞癌(HNSCC)患者的一线治疗。
结直肠癌
2021年6月11日:获批用于不可切除或转移性MSI-H(微卫星高度不稳定性)或dMMR(错配修复缺陷)结直肠癌(CRC)患者的一线治疗。
2023年9月8日:获批用于不可切除或转移性微卫星高度不稳定型(MSI-H)或错配修复基因缺陷型(dMMR)成人晚期实体瘤患者,其中包括既往接受过氟尿嘧啶类、奥沙利铂和伊立替康治疗后疾病进展的结直肠癌患者,及既往治疗后疾病进展且无满意替代治疗方案的其他实体瘤。
肝细胞癌
2022年10月9日:获批单药用于治疗既往接受过索拉非尼或含奥沙利铂化疗的肝细胞癌(HCC)患者。
三阴性乳腺癌
2022年11月7日:获批联合化疗新辅助治疗并在手术后继续帕博利珠单抗单药辅助治疗,用于经充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥20)的早期高危三阴性乳腺癌(TNBC)患者的治疗。
胃/胃食管结合部腺癌
2023年12月18日:获批联合含氟尿嘧啶类和铂类药物化疗,用于局部晚期不可切除或转移性HER-2阴性胃/胃食管结合部腺癌(G/GEJC)患者的一线治疗。
胆道癌
2024年2月4日:获批联合吉西他滨和顺铂化疗,用于局部晚期或转移性胆道癌(BTC)患者的一线治疗。
帕博利珠单抗在中国获批的适应症涵盖了多种肿瘤类型,包括黑色素瘤、肺癌、食管癌、头颈部鳞状细胞癌、结直肠癌、肝细胞癌、三阴性乳腺癌、胃/胃食管结合部腺癌和胆道癌,为肿瘤患者提供了更多治疗选择,并显著改善了患者的生存预后。












