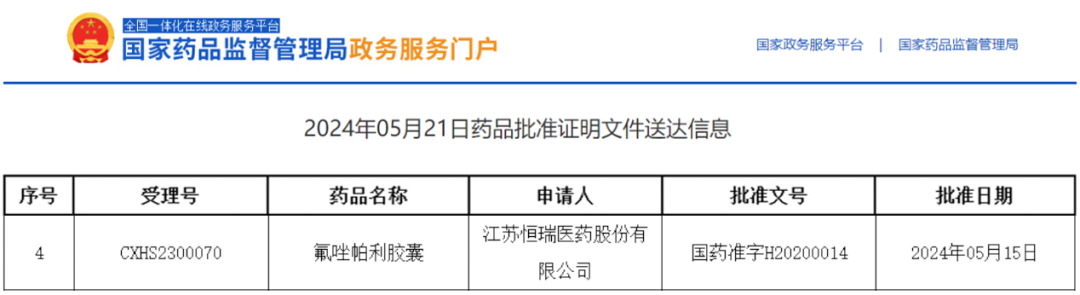
2024年5月15日国家药监局批准氟唑帕利胶囊(Fluzoparib/Fuzuloparib、艾瑞颐、SHR3162、Synonyms)用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌的一线维持治疗
小编 2024-09-19
2024年5月15日国家药监局批准氟唑帕利胶囊(Fluzoparib/Fuzuloparib、艾瑞颐、SHR3162、Synonyms)用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌的一线维持治疗
2024年5月15日,中国国家药品监督管理局(NMPA)批准恒瑞医药自主研发的1类新药——氟唑帕利胶囊\(Fluzoparib/Fuzuloparib、艾瑞颐、SHR3162、Synonyms)用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者在含铂化疗达到完全缓解或部分缓解后的一线维持治疗。这一里程碑式的获批不仅标志着氟唑帕利在晚期卵巢癌治疗领域的进一步拓展,也为广大患者带来了新的治疗选择和希望。
获批依据
氟唑帕利此次获批主要基于一项名为FZOCUS-1的3期临床试验,该研究为晚期卵巢癌患者的治疗提供了强有力的循证医学证据。
研究设计
FZOCUS-1研究是一项随机、双盲、安慰剂对照、多中心的3期临床试验,旨在评估氟唑帕利单药或联合阿帕替尼对比安慰剂在晚期卵巢癌一线含铂化疗后维持治疗的有效性和安全性。
入组人群:共计入组674例新诊断的FIGO III/IV期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者,所有患者均接受了肿瘤细胞减灭术联合6-9个周期一线含铂化疗且达到完全缓解或部分缓解。
分组情况:受试者按2:2:1的比例随机分配至氟唑帕利单药组、氟唑帕利联合阿帕替尼组和安慰剂组接受维持治疗,直至疾病进展、毒性不可耐受或达到最长治疗时间为2年。
主要终点:由盲态独立评审委员会(BIRC)根据RECIST v1.1标准评估的全人群及BRCA1/2突变人群亚组的无进展生存期(PFS)。
次要终点:包括研究者评估的PFS、总体最佳疗效(BoR)、从随机分组到治疗结束或死亡的时间(TDT)、总生存期(OS)、安全性等。
研究结果
截至2023年3月31日,FZOCUS-1研究进行了预先设定的期中分析,结果显示:
显著延长PFS:氟唑帕利单药组的中位PFS尚未达到,而安慰剂组的中位PFS仅为11.1个月,这意味着氟唑帕利能够显著延长患者的生存时间。
全人群获益:在ITT(意向治疗)人群中,氟唑帕利单药组相比安慰剂组,PFS得到显著改善(HR=0.49,P<0.0001)。
BRCA突变人群获益:在BRCA1/2突变人群中,氟唑帕利单药组的中位PFS尚未达到,而安慰剂组的中位PFS为14.9个月(HR=0.40,P=0.000938),表明BRCA突变人群从氟唑帕利治疗中获益更大。
BRCA野生型人群同样获益:在BRCA1/2野生型人群中,氟唑帕利单药组的中位PFS为25.5个月,而安慰剂组的中位PFS为8.4个月(HR=0.53,P=0.0001),表明BRCA野生型人群同样能够从氟唑帕利治疗中获益。
安全性良好:氟唑帕利组最常见的3级及以上治疗相关不良事件为贫血、血小板计数下降和中性粒细胞计数下降,且未发生骨髓增生异常综合征、急性髓系白血病或与治疗相关的死亡事件。
研究结论
FZOCUS-1研究结果表明,氟唑帕利单药维持治疗能够显著延长晚期卵巢癌患者的PFS,且无论患者是否存在BRCA突变,均能从氟唑帕利治疗中获益,安全性良好。这一研究结果为氟唑帕利新适应症的获批提供了坚实的证据基础。
研究意义
FZOCUS-1研究的成功,标志着氟唑帕利在晚期卵巢癌治疗领域取得了重要突破,为患者带来了新的治疗选择,同时,该研究也为PARP抑制剂在晚期卵巢癌一线维持治疗中的应用提供了重要参考,推动了卵巢癌治疗的进步。












