官宣!近50%的肺癌患者肿瘤消失或大幅缩小!国内首个KRAS抑制剂达伯特获批上市!
小编 2024-08-23
国内首个KRAS抑制剂氟泽雷塞片(Fulzerasib、达伯特/Dupert、GFH925)获批上市,近50%的肺癌患者肿瘤消失或大幅缩小
KRAS是人类最常见的致癌突变之一,尤其是在胰腺导管腺癌(PDAC)、非小细胞肺癌(NSCLC)和结直肠癌(CRC)中。作为靶向治疗中的“钉子户”一般的存在,近40年来,几乎所有靶向药都在KRAS基因突变的面前纷纷折戟。
2024年8月21日,中国国家药监局(NMPA)官网公示,达伯特®(氟泽雷塞片;信达研发代号:IBI351;劲方研发代号:GFH925)已获中国国家药品监督管理局药品审评中心批准上市,用于至少接受过一种系统性治疗的鼠类肉瘤病毒癌基因G12C(KRAS G12C)突变型的晚期非小细胞肺癌(NSCLC)成人患者。达伯特®(氟泽雷塞片)是中国首个获批的KRASG12C抑制剂,将惠及更多中国KRASG12C突变型的肺癌患者。
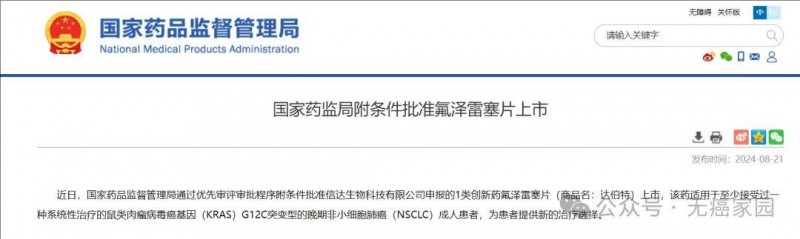
截图源自NMPA官网
此前,2023年11月24日,中国国家药品监督管理局已经正式受理IBI-351(KRAS G12C抑制剂)的新药上市许可申请并纳入优先审评程序。
近50%肺癌患者肿瘤消失或缩小!国内首个KRAS抑制剂达伯特获批上市
达伯特®(氟泽雷塞片)是一款国研的新型、具有口服活性的强效KRAS G12C抑制剂,通过阻断KRAS依赖的信号转导,抑制肿瘤细胞的增殖,并诱导细胞凋亡。
此前,该获批药物于2023年1月被CDE纳入突破性治疗品种,拟用于治疗至少接受过一种系统性治疗的KRAS G12C突变型的晚期非小细胞肺癌(NSCLC)患者。
此次新药上市是基于一项在中国开展的临床II期单臂注册研究结果。数据截至2023年12月13日,共纳入116例非小细胞肺癌患者,中位随访时间为15.1个月。

截图源自《JTO》杂志
官网数据显示,独立影像学评审委员会(IRRC)评估的确认的客观缓解率(ORR)达49.1%;疾病控制率(DCR)达90.5%。
中位缓解持续时间(DoR)未达到,12个月DoR率为53.7%。中位无进展生存期(mPFS)9.7个月,12个月PFS率为37.9%;中位生存期(OS)尚未达到,12个月OS率为54.4%。
亚组分析显示,各亚组在IBI351单药治疗中基本取得一致获益,包括预后较差的脑转移患者。35例(30.2%)基线脑转移患者经IRRC确认的ORR为48.6%,DCR为94.3%;81例基线无脑转移患者经IRRC确认的ORR为49.4%,DCR为88.9%,两者肿瘤应答状况相似。
基线无脑转移患者的mPFS和mOS分别为10.4个月、14.1个月,均优于脑转移患者的6.4个月和10.9个月。此外,氟泽雷塞颅内ORR为22.6%,颅内DCR达 96.8%,且所有颅内缓解患者均为完全缓解(CR)。
总而言之,IBI351单药治疗在既往经治的KRAS G12C突变晚期非小细胞肺癌中具有优异的疗效和良好的耐受性。
目前无癌家园有多款针对KRAS G12C的靶向药正在招募中!
想要评估病情是否符合上述招募条件可将病理报告、治疗经历及出院小结等提交至医学部进行初步评估!
靶病灶缩小100%!IBI351联合西妥昔单抗挑战一线治疗肺癌
Fulzerasib(IBI351)是一种KRAS G12C创新小分子抑制剂,在以往治疗过的非小细胞肺癌患者的单药治疗中,已表现出显著的治疗效果。表皮生长因子受体 (EGFR) 的激活被认为是 KRAS 抑制耐药的主要机制之一。临床前证据表明,在 KRAS G12C 突变 NSCLC 模型中使用Fulzerasib(IBI351)与西妥昔单抗具有协同作用。
因此,在2024年ASCO大会上,我国的研究学者们公布了关于两者联合一线治疗KRAS G12C非小细胞肺癌的II期临床研究结果,这也是全球首个KRAS G12C抑制剂联合EGFR抑制剂用于一线NSCLC治疗的临床数据在国际学术会议公布。
截至2024年4月19日,共纳入40例NSCLC患者,其中33例接受过至少一次治疗后肿瘤评估:客观缓解率(ORR)为81.8%,疾病控制率(DCR)高达100%;多数可评估患者(27/33)达到肿瘤缓解,其中1例达到完全缓解,另外2例达到部分缓解的患者也观察到靶病灶缩小100%。此外,这项联合疗法具有良好可控的安全性及耐受性。
疾病控制率90%!国内首个KRAS抑制剂达伯特宣战结直肠癌
除了非小细胞肺癌外,2023年5月,GFH925(IBI351)还被纳入突破性疗法,用于治疗至少接受过一种系统性治疗的KRAS G12C突变型的晚期结直肠癌患者。
截止到2023年6月13日,共有56例转移性结直肠癌患者被纳入分析(其中700mg QD 3名受试者,450mg BID 4名受试者,600mg BID 48名受试者和750mg BID 1名受试者) 。
结果显示:600mg BID剂量组中共有48例受试者接受了至少一次肿瘤评估,确认的客观缓解率(cORR)为45.8%,疾病控制率(DCR)为89.6%。其中共有27例受试者既往接受了2线及以上的系统性治疗,确认的ORR为63.0%,DCR为88.9%。
尚未达到中位缓解持续时间 (DoR),6个月DoR率为65.5%。中位PFS为7.6个月。尚未达到中位OS,6个月OS率为91.1%。安全性方面,截至数据分析日,总体耐受性良好。初步数据显示IBI351单药在KRASG12C突变的晚期结直肠癌患者中展示出了良好的安全性和令人鼓舞的疗效。我们期待该研究有更多的积极持续的结果更新。
国产抗癌药向最难靶点宣战!创新KRAS G12C抑制剂获批临床
其实,在医学研究者们不断地努力之下,KRAS这座堡垒终于破防,多款新药不断涌现,并已有多个在研药物在临床研究阶段取得了早期成功:包括:D-1553、JNJ-74699157 (ARS-3248)、JAB-3312、LY3499446以及泛KRAS抑制剂BI 1701963等。
1、首战告捷!国产抗癌药JAB-21822客观缓解率高达70%
2022年12月16日,加科思发布公告称,公司自主研发的KRAS G12C抑制剂JAB-21822获得国家药监局药品审评中心授予突破性治疗药物认定,用于治疗KRAS G12C突变的晚期或转移性非小细胞肺癌(NSCLC)患者。此次认定是基于JAB-21822前期良好的疗效和安全特性。
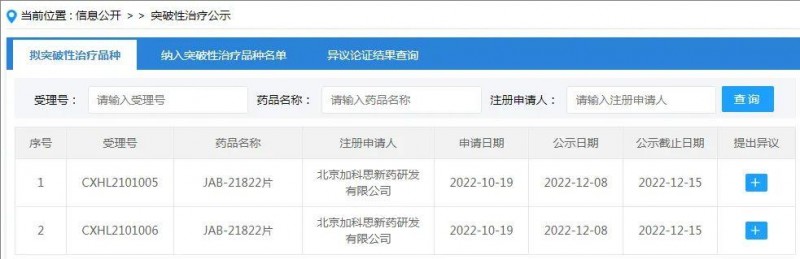
图源CDE官网
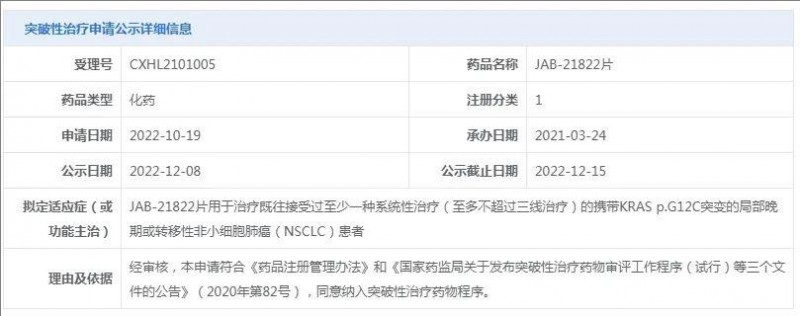
图源CDE官网
JAB-21822是加科思自主研发的KRAS G12C抑制剂。临床前研究数据表明,其可单独使用,治疗含KRAS G12C突变的实体瘤,同时在KRAS G12C抑制剂治疗发生耐药后,联合SHP2抑制剂有望有效克服和逆转KRAS抑制剂的耐药问题。

JAB-21822研究进度(图源加科思官网)
在2022年ASCO大会上,加科思公布的1期临床数据显示,截至2022年4月1日共入组72例晚期实体瘤患者。其中有疗效评估的KRAS G12C突变的非小细胞肺癌患者共32例,客观缓解率(ORR)为56.3%(18/32),疾病控制率(DCR)为90.6%(29/32)。在400mg/d及800mg/d的剂量组中,客观缓解率为66.7%(8/12),疾病控制率为100%(12/12)。此外,JAB-21822在剂量递增阶段无剂量限制性毒性(DLT),400mg/d及800mg/d剂量组中三级或四级治疗相关不良反应为2.5%(1/40)。
在KRAS G12C突变的实体瘤患者中,JAB-21822有良好的耐受性,并且具有显著有效性。
2、疾病控制率85.7%,国产靶向药D-1553首次亮相AACR
D-1553是由益方生物自主开发的一款新型、高效且口服的KRAS G12C抑制剂。在2022年美国肿瘤研究协会(AACR)年会上,益方生物首次公布了其口服KRAS G12C抑制剂D-1553在癌症患者中的临床I期数据,这使得D-1553成为了首个公布临床数据的国产KRAS抑制剂。
在一项针对携带KRAS G12C突变的晚期或转移性实体瘤患者的国际多中心一期研究中 ,D-1553在22例患者中耐受性良好,没有任何剂量限制性毒性。在21例可评估的患者中,观察到19.0%确认的肿瘤客观缓解率,达到了85.7%的疾病控制率。在剂量水平低至每天300mg时已观察到肿瘤缓解。
在另一项由上海胸科医院陆舜教授为主要研究者,针对携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者的研究分析中包括了59例患者,其中52例为可评估患者,肿瘤客观缓解率达到40.4%,疾病控制率高达90.4%。这些患者均为晚期或转移性癌症患者,大多数已经接受了二线或二线以上的系统性抗癌药物治疗。
数据显示,在PR2D(600mg/BID,BID为一日两次)剂量下,D-1553在32例患者中评估的客观缓解率达到40.6%,疾病控制率为84.4%。安全性方面,D-1553耐受性良好,未达到剂量限制性毒性。
据悉,D-1553已于2020年10月获得美国FDA批准在美国、澳大利亚、中国台湾、韩国等国家和地区启动了国际多中心I/II期临床试验,目前进展顺利。并于2021年1月获得中国国家药品监督管理局药品审评中心批准开展 I/II 期临床试验。
3、君实生物的KRAS抑制剂JS116首次在国内申请临床
2022年3月28日,中国国家药品监督管理局药品审评中心(CDE)官网显示,君实生物的KRAS抑制剂JS116首次在国内申请临床。JS116为具有全新结构的KRASG12C小分子不可逆共价抑制剂,用于治疗 KRASG12C 突变的非小细胞性肺癌(NSCLC)患者。

CDE官网截图
KRAS基因突变有不同的亚型,其中KRASG12C占所有KRAS突变的44%,在NSCLC中最为常见。临床前研究表明,JS116具有较宽的安全窗,良好的有效性和安全性,有望成为安全、高效的精准靶向治疗药物。这也是君实在国内申报的第7款化药新药。
小编有话说
此外,有研究表明,KRAS G12C靶向药与其他免疫药、靶向药的联用效果会更佳!此次研究也证实联合用药或许可以让更多的癌症患者从中获益。小编也相信,在未来将会有众多KRAS靶向药不断涌现,让更多患者有药用,用好药!
参考文献
1.https://www.nmpa.gov.cn/zhuanti/cxylqx/cxypxx/20240821175034132.html
2.https://www.jto.org/article/S1556-0864(24)00762-7/abstract
3.https://ascopubs.org/doi/10.1200/JCO.2024.42.17_suppl.LBA8511
4.https://www.prnewswire.com/news-releases/innovent-presents-phase-1-clinical-data-of-ibi351-krasg12c-inhibitor-as-monotherapy-for-linkstatic-colorectal-cancer-at-the-2023-asco-annual-meeting-301842178.html
5.https://www.prnewswire.com/news-releases/innovent-announces-updated-data-of-phase-1-clinical-trial-for-ibi351-krasg12c-inhibitor-as-monotherapy-for-solid-tumors-at-the-aacr-annual-meeting-2023-301798884.html












