2024年6月13日FDA加速批准了瑞普替尼(瑞波替尼、Augtyro、Repotrectinib)用于治疗NTRK基因融合阳性的实体瘤
小编 2024-08-08
2024年6月13日FDA加速批准了瑞普替尼(瑞波替尼、Augtyro、Repotrectinib)用于治疗NTRK基因融合阳性的实体瘤
2024年6月13日,美国食品药品监督管理局(FDA)加速批准了瑞普替尼(瑞波替尼、Augtyro、Repotrectinib)用于治疗NTRK基因融合阳性的实体瘤患者。这一批准标志着瑞普替尼成为首款同时适用于NTRK抑制剂(TKI)初治和经治患者的疗法,为更多患者带来了福音。

获批依据
瑞普替尼的此次获批主要基于TRIDENT-1研究的结果,这是一项多中心、单臂、开放标签、多队列的1/2期临床试验,旨在评估瑞普替尼在NTRK基因融合阳性的局部晚期或转移性实体瘤患者中的疗效和安全性。
研究设计
TRIDENT-1研究是一项精心设计的临床试验,旨在全面评估瑞普替尼在NTRK基因融合阳性的实体瘤患者中的疗效和安全性,该研究采用多中心、单臂、开放标签、多队列的设计,确保了研究结果的可靠性和广泛性。
患者入组
TRIDENT-1研究纳入了88例NTRK基因融合阳性的实体瘤患者,这些患者来自全球多个研究中心,涵盖了不同类型的实体瘤,包括肺癌、甲状腺癌、肉瘤等。患者被分为两组:
●TKI初治组(n=40):这些患者既往未接受过任何TRK TKI治疗;
●TKI经治组(n=48):这些患者既往曾接受过至少一种TRK TKI治疗,并且对之前的治疗产生了耐药性。
研究终点
TRIDENT-1研究的主要终点是客观缓解率(ORR),即肿瘤缩小达到一定程度的患者比例。次要终点包括:
●缓解持续时间(DOR):肿瘤缩小达到一定程度的患者中,肿瘤持续缩小的时间;
●无进展生存期(PFS):患者从开始接受治疗到肿瘤出现进展或死亡的时间;
●总生存期(OS):患者从开始接受治疗到死亡的时间;
●颅内客观缓解率(iORR):脑转移患者的肿瘤缩小达到一定程度的患者比例。
研究结果
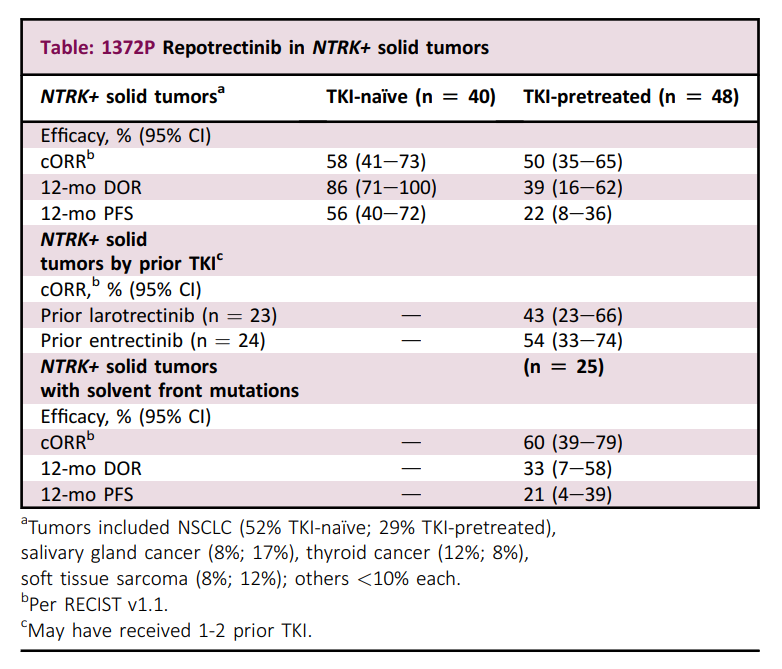
TRIDENT-1研究的结果令人鼓舞,瑞普替尼在TKI初治组和TKI经治组中均展现出显著的疗效:
●TKI初治组:ORR达到58%,中位DOR尚未达到。这意味着超过一半的患者肿瘤缩小,并且其中有83%的患者在接受瑞普替尼治疗一年后仍持续缓解;
●TKI经治组:ORR为50%,中位DOR为9.9个月。这表明瑞普替尼对TKI经治患者仍然有效,并且能够显著延长患者的生存期;
●脑转移患者:在基线时有可评估中枢神经系统(CNS)转移的患者中,2名TKI初治患者和3名接受过TKI治疗的患者均观察到颅内缓解,表明瑞普替尼能够有效控制脑转移。
耐药突变分析
TRIDENT-1研究还对TKI经治患者的耐药突变进行了分析,结果显示:
●溶剂前沿突变:25例在基线存在溶剂前沿突变的TKI经治患者中,ORR为60%,表明瑞普替尼能够克服一代TRK抑制剂的耐药性;
●守门人突变:1例存在守门人突变的患者对瑞普替尼也产生了响应,这表明瑞普替尼可能对多种耐药突变均有效。
安全性
TRIDENT-1研究还评估了瑞普替尼的安全性,结果显示,瑞普替尼的安全性良好,最常见的不良反应包括头晕、味觉障碍、周围神经病变等,大多数不良反应可通过调整剂量或对症治疗得到控制。
NTRK基因融合
NTRK基因融合是一种常见的基因变异,在多种实体瘤中均有发现,如肺癌、甲状腺癌、肉瘤等。NTRK基因融合会导致TRK蛋白异常激活,从而促进肿瘤细胞生长。
瑞普替尼简介
瑞普替尼是一种新型酪氨酸激酶抑制剂,能够选择性抑制TRK蛋白,从而阻断肿瘤细胞的生长信号,抑制肿瘤细胞增殖。
瑞普替尼的优势
●克服耐药性:瑞普替尼能够克服一代TRK抑制剂的耐药性,对TRK TKI初治/经治的患者都有效;
●安全性良好:瑞普替尼的副作用相对较小,患者耐受性良好;
●疗效显著:瑞普替尼能够显著延长患者的生存期,改善患者的生活质量。
瑞普替尼的获批历程
2023年11月:瑞普替尼获得FDA完全批准,用于治疗ROS1阳性局部晚期或转移性非小细胞肺癌成人患者;
2024年5月:瑞普替尼获得中国国家药监局批准,用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者;
2024年6月13日:瑞普替尼获得FDA加速批准,用于治疗NTRK基因融合阳性的实体瘤患者。
结语
瑞普替尼的获批为NTRK基因融合阳性的实体瘤患者带来了新的治疗选择,也为精准医疗在癌症治疗中的应用提供了新的范例。未来,瑞普替尼有望应用于更多类型的肿瘤,为更多患者带来希望。












