2024年1月12日FDA批准帕博利珠单抗注射液(Pembrolizumab、可瑞达/Keytruda)联合放化疗用于治疗III-IVA期宫颈癌
小编 2024-07-16
2024年1月12日FDA批准帕博利珠单抗注射液(Pembrolizumab、可瑞达/Keytruda)联合放化疗用于治疗III-IVA期宫颈癌
2024年1月12日,美国食品和药物管理局(FDA)正式批准了帕博利珠单抗(Pembrolizumab、可瑞达/Keytruda)联合放化疗用于治疗国际妇产科联盟(FIGO)2014所定义的III-IVA期宫颈癌的新适应症。这一决定标志着免疫治疗在宫颈癌治疗领域的重要进展,为患者提供了新的希望。这一批准基于III期ENGOT-cx11/GOG-3047/KEYNOTE-A18研究的显著成果,标志着宫颈癌治疗领域的一个重要里程碑。

获批依据
此次帕博利珠单抗获批基于KEYNOTE-A18 III期临床试验的结果,该研究纳入了1060例FIGO 2014年分期为IB2-IIB期淋巴结阳性或III-IVA期的高危局部晚期宫颈癌患者,随机分为帕博利珠单抗联合放化疗组和安慰剂联合放化疗组。
研究设计
ENGOT-cx11/GOG-3047/KEYNOTE-A18是一项随机、双盲、安慰剂对照的III期临床试验,涵盖了来自30个国家176个医疗中心的1060名患者,研究对象为年龄≥18岁、ECOG PS评分为0~1、未接受过全身治疗/免疫治疗/确定性手术或放疗的新诊断高危局部晚期宫颈癌患者,患者以1:1的比例随机分配至帕博利珠单抗联合放化疗组和安慰剂联合放化疗组。
治疗方案
帕博利珠单抗联合放化疗组接受5个周期的帕博利珠单抗(200mg,Q3W)联合放化疗,随后接受15个周期的帕博利珠单抗(400mg,Q6W)治疗;而安慰剂联合放化疗组则接受相同周期的安慰剂治疗。
主要和次要终点
主要终点为研究者评估的无进展生存期(PFS)和总生存期(OS),关键次要终点包括盲态独立中心评估的PFS、24个月OS率和PFS率、根据PD-L1状态确定的PFS和OS、PFS2、客观缓解率(ORR)、12周完全缓解率(CR)、患者报告结局及安全性。
研究结果
患者特征
研究纳入了符合条件的1060名患者,其中帕博利珠单抗联合放化疗组529例,安慰剂联合放化疗组531例,患者中61.3%为盆腔淋巴结阳性,2.3%为腹主动脉旁淋巴结阳性,19.7%为盆腔和腹主动脉旁淋巴结阳性,16.7%无淋巴结阳性,94.3%的患者PD-L1阳性。
研究结果
帕博利珠单抗联合放化疗组在无进展生存期(PFS)和总生存期(OS)方面均显著优于安慰剂联合放化疗组:
PFS:帕博利珠单抗组24个月PFS率为68%,安慰剂组为57%,疾病进展或死亡风险降低30%。
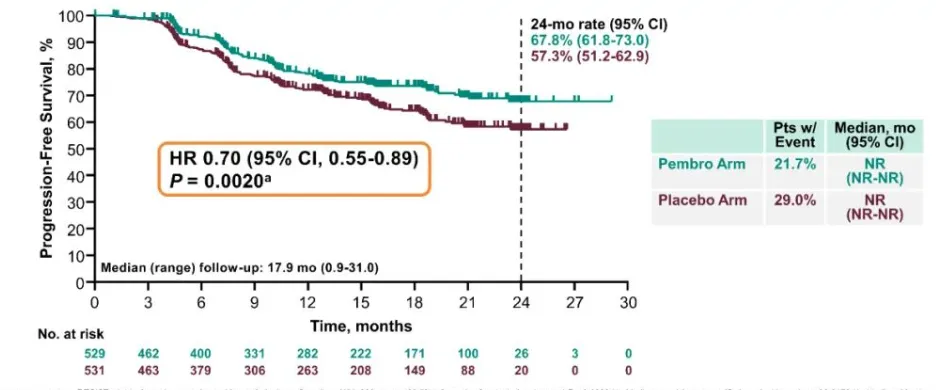
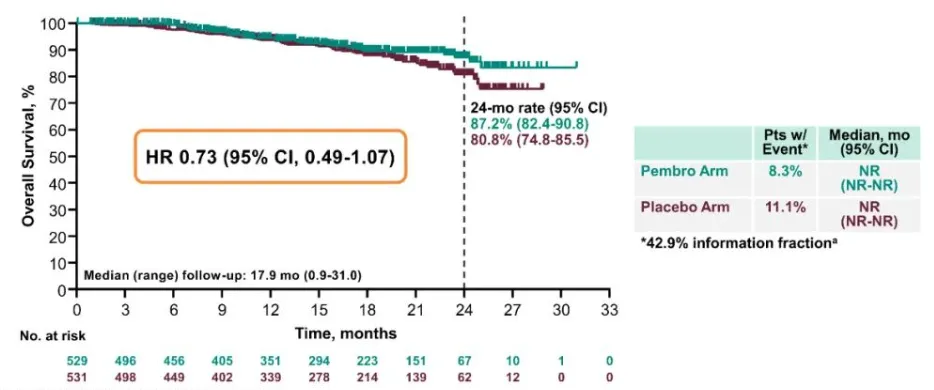
OS:帕博利珠单抗组24个月OS率为87%,安慰剂组为81%,死亡风险降低27%。
疗效分析
帕博利珠单抗联合放化疗组的24个月PFS率为68%,显著高于安慰剂联合放化疗组的57%,在PD-L1阳性患者中,疾病进展或死亡的风险降低了28%,此外,帕博利珠单抗联合放化疗组的24个月OS率为87%,也显著高于对照组的81%。
安全性和耐受性
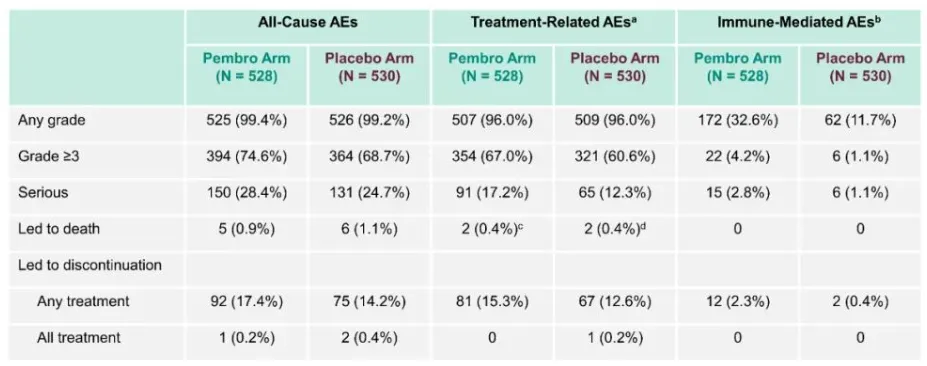
尽管帕博利珠单抗带来了显著的生存益处,但其安全性也是评估中的一个重要方面,在ENGOT-cx11/GOG-3047/KEYNOTE-A18试验中,大多数不良事件是可控的,且与已知的帕博利珠单抗安全性档案一致,常见的不良反应包括甲状腺功能异常、白细胞减少和低钾血症等,这些发现表明,当适当管理时,帕博利珠单抗联合放化疗的治疗方案具有良好的耐受性。
治疗机制与优势
帕博利珠单抗之所以能在宫颈癌治疗中展现出如此优异的疗效,主要得益于其独特的免疫调节机制,通过抑制PD-1信号通路,帕博利珠单抗能够解除肿瘤对免疫系统的抑制,激活T细胞等免疫细胞对肿瘤细胞的攻击,这种“重启”免疫系统的治疗方式,不仅可以直接杀灭肿瘤细胞,还能通过诱导免疫记忆,防止肿瘤复发。
此外,帕博利珠单抗联合放化疗的治疗方案还具有以下优势:
协同增效:放化疗能够破坏肿瘤细胞的DNA,诱导免疫原性细胞死亡,从而释放更多的肿瘤抗原,促进免疫细胞的识别和攻击,帕博利珠单抗则能够进一步增强这种免疫应答,实现“1+1>2”的治疗效果。
适用广泛:该治疗方案不仅适用于FIGO 2014 III-IVA期宫颈癌患者,还可能为其他阶段的宫颈癌患者带来益处,未来,随着研究的深入,帕博利珠单抗的适应症有望进一步拓宽。
结语
帕博利珠单抗联合放化疗治疗FIGO 2014 III-IVA期宫颈癌的新适应症获批,标志着免疫治疗在妇科肿瘤领域的又一次重大突破,这不仅为宫颈癌患者提供了新的治疗选择,也展现了精准医疗在癌症治疗中的潜力,随着医学研究的不断深入,期待未来能有更多创新疗法问世,为患者带来更多希望。












