质子疗法在胰腺癌中的应用
小编 2022-07-14
质子治疗胰腺癌,质子疗法在胰腺癌中的应用
质子治疗没有出射剂量并且对附近危及器官(OAR)的照射最小,在胃肠道癌症治疗中可以进一步降低毒性。随着质子治疗在胰腺癌治疗中出现的频率越来越高,人们对质子治疗胰腺癌的应用越来越感兴趣。但由于肿瘤运动和邻近胃、十二指肠和肠等OAR,质子照射胰腺在计划靶区照射剂量时仍然存在挑战。

方法
本文为叙述性综述。使用PubMed搜索“质子治疗”和“胰腺癌”的文献,检索结果按标题和摘要进行扫描,并纳入相关文章。为了确保全面性,还扫描了每篇选定文章的参考文献和“被引”论文列表。没有应用特定的排除标准,并且纳入了所有原始研究文章,包括同行评审的论文和会议/海报摘要。从Clinicaltrials.gov在“状况或疾病”项使用“胰腺癌”,在“其他方面”项使用“质子治疗”搜索前瞻性研究。纳入剂量数据、临床数据和前瞻性试验,分别分析质子治疗在胰腺癌治疗中的应用及进展。
剂量数据
与3D-CRT和IMRT相比,在不能手术切除的胰腺癌中,照射剂量为50 Gy和额外增加20 Gy剂量时,点扫描质子治疗可改善适形性和剂量均匀性,而发病率没有增加。质子与3D-CRT比较,OAR剂量减少,最明显部位是左肾和脊髓。随着剂量加大到72 Gy和计划靶区体积(PTV)虚拟转换到胰腺内的11个不同位置,质子在正常组织剂量保留方面优于光子,特别是肿瘤位于后方时。
质子治疗在胰腺癌新辅助治疗中的应用研究表明,质子治疗的大分割方案(5 CGE×5次)是可行的。质子治疗和IMRT计划使靶区覆盖50.4 Gy时,质子治疗可更好地保护OAR,小肠(15.4% vs. 47.0%,p=0.0156)和胃(2.3% vs. 20.0%,p=0.0313)剂量显著降低。
质子治疗应用于不可切除的胰腺癌时。与IMRT相比,质子治疗减少了对肾脏、肝脏和脊髓,以及胃、十二指肠和小肠的照射暴露。值得注意的是,最后三个OAR暴露的减少仅适用于低剂量区域(V20Gy,p<0.01),而中高区域的剂量实际上增加了(胃部IMRT V45Gy为3.9%,而质子双散射和笔形束扫描(PBS)的V45Gy分别为5.8%和4.5%,p<0.05)。
质子治疗使用不同计划技术时。使用调制扫描技术计划的质子治疗比使用被动散射质子治疗更能减少OAR剂量,且两种质子技术都优于基于光子的计划(IMRT,体积调制弧治疗和3D-CRT)。与双散射相比,PBS显示出剂量学优势,有较好的靶区适形性,并可减少OAR剂量,包括肠道和脊髓(0.1 cc肠道空间的中位剂量为61 Gy(RBE) vs. 62.6 Gy(RBE),p=0.001)。
胰腺的靶区剂量容易受多种因素影响。其中之一是大肠内容物变化,当肠道充满气体时,临床靶区体积(CTV)覆盖率和脊髓剂量会发生显著变化;另一个重要因素是肿瘤分次间运动,在质子和光子计划比较中,靶区覆盖率显著降低。为了减轻这种影响,德国癌症研究中心的团队建议使用4D-MRI进行规划以及门控和28天分割进行治疗。这些变化在28个分次时显著改善。在大分割治疗的情况下,例如立体定向体质子治疗(SBPT)可减少肿瘤运动变化。
在单野或多野非鲁棒优化(SFO/MFO)之后,靶区覆盖和正常组织剂量保留都受到范围不确定性和运动的影响,并且它们之间的最佳折中方法在SFO计划中使用6 mm光斑尺寸和5 mm优化靶区体积(OTV)扩展。
质子治疗的有限范围是一把双刃剑。一方面,它为器官保护提供了急剧的剂量下降和零出射剂量;另一方面,它的束流远端受到范围不确定性和生物增强效应的影响,导致靶区和远端器官剂量测量出现偏差。如果管理不当,射程不确定性可能会导致靶区覆盖损失(低于射程)或场地远端的OAR剂量过大(超射程)。考虑到束流路径的异质性,并且通常会计算水当量束流路径长度3%~5%的额外边际,可减少规划和范围的不确定性,并进一步优化靶区远端器官的剂量。在胰腺癌患者的4DCT评估中经常观察到由呼吸运动和日常解剖结构变化引起的束流路径变化。应特别注意减少质子治疗中的距离不确定性余量,尤其是在涉及移动靶区和/或不稳定束流路径的情况下。
研究表明,通过注射间隔凝胶可以增加肿瘤和肠道之间的分离,减少胰腺癌患者的肠道剂量。4D动态CT、相对生物有效性(RBE)增强计划和IMPT线性能量转移(LET)引导优化都可以提高质子治疗对肿瘤运动的鲁棒性。
临床数据
考虑到范围不确定性、肿瘤运动不确定性以及胰腺肿瘤与周围OAR(主要是肠道)非常接近,质子治疗计划的临床实施具有挑战性。图1总结了质子治疗在胰腺癌治疗中的临床研究时间表。为了降低OAR毒性并提高肿瘤接受的剂量,可在肿瘤和胃肠道之间放置填充物。
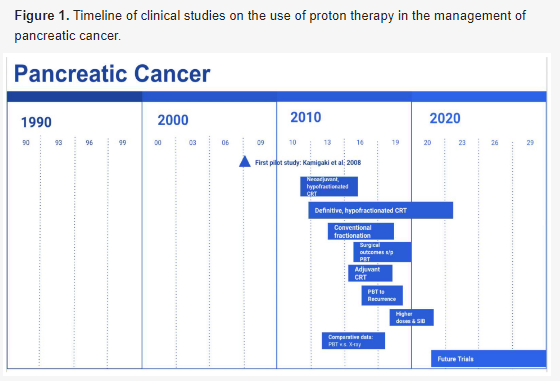
图1. 使用质子治疗胰腺癌的临床研究时间表
质子治疗用于辅助治疗耐受性较好,可以提供良好的局部控制。在局部复发并随后接受质子治疗的30例患者中,有23例患者出现进展,局部复发9例。中位局部无进展生存期(LPFS)为41.2个月,明显长于12.3个月的平均PFS。对复发性胰腺癌进行再照射研究中,至少3个月前接受过质子治疗的15例患者再次接受质子治疗以治疗局部复发的胰腺肿瘤,再照射耐受性良好,急性3+级毒性发生率为13%,1年OS和LPFS分别为67%和72%。值得注意的是,同时接受化疗和质子再照射的患者的中位生存期高于未接受化疗的患者。
在几项研究中评估了质子治疗剂量和同步整合加量(SIB)的可行性,较高的放射剂量与较高的总体生存率(p=0.015)和局部控制(p=0.023)相关。没有报告严重的胃肠道毒性。接受诱导化疗患者中位总生存期显著更高(21.6个月 vs. 16.7个月,p=0.031)。
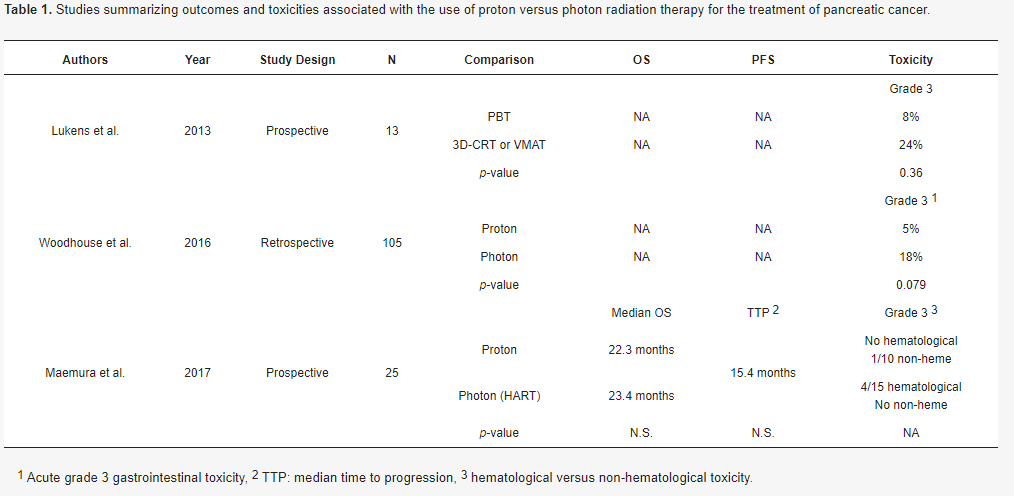
虽然有几项研究调查了质子治疗在胰腺癌治疗中的作用,但很少有人将其与光子治疗进行比较。虽然质子计划导致胃接受的剂量要少得多,但它们并未导致3级急性胃肠道毒性发生率(8%与24%,p=0.36)。来自同一机构的研究人员进行的另一项比较,纳入了更多患者,包含105例接受辅助放化疗患者的回顾性研究,却显示了相似的结果,接受质子治疗的患者急性3级胃肠道毒性发生率为5%,接受光子治疗的患者为18%(p=0.079)。质子组平均住院次数也没有显著降低(0.95次vs. 1.31次,p=0.276),总体生存率没有差异。目前,还不清楚真正该减少多少,或者应该纳入多少例患者,才能使检测结果具有统计学意义。表1总结并比较质子和光子治疗胰腺癌的研究。
表1. 质子与光子治疗胰腺癌相关结果和毒性研究总结
前瞻性试验
目前,确实比较质子和光子模式治疗胰腺癌的随机试验,也没有此类试验正在进行,仅有几个I/II期单臂试验。质子协作组目前正在评估接受化疗质子治疗的临界可切除、可切除或不可切除肿瘤患者的总体生存率,这些患者在选择性淋巴结照射的剂量增加。图2总结关于质子治疗在胰腺癌治疗中的研究,按其特殊重点和发表时间进行分层。
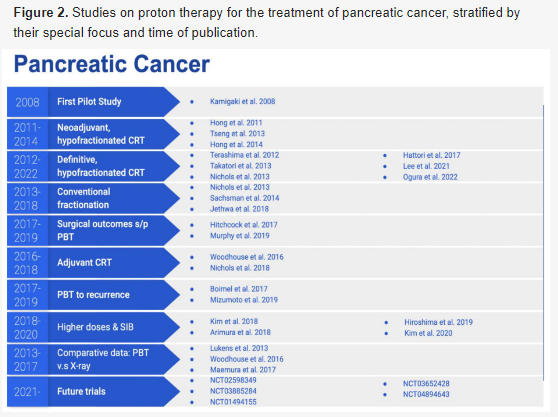
图2. 质子治疗胰腺癌的研究,按其特别关注点和发表时间分层
结论
质子治疗在胰腺癌中的应用(无论是剂量学还是临床应用),已从可切除病灶的新辅助放化疗到不可切除病灶的明确管理。迄今为止,并没有随机比较数据显示质子和光子照射在肿瘤学结果或毒性方面的统计学差异。还需要进一步的研究来优化分割方案和同步化疗。
参考文献:Kobeissi JM, Simone CB 2nd, Lin H, et al. Proton Therapy in the Management of Pancreatic Cancer. Cancers (Basel). 2022 Jun 4;14(11):2789.
内容来源:质子中国












